Calcular la masa remanente luego de transcurrido 5 años ....
,
,
 ..
.. 

 .
.

.
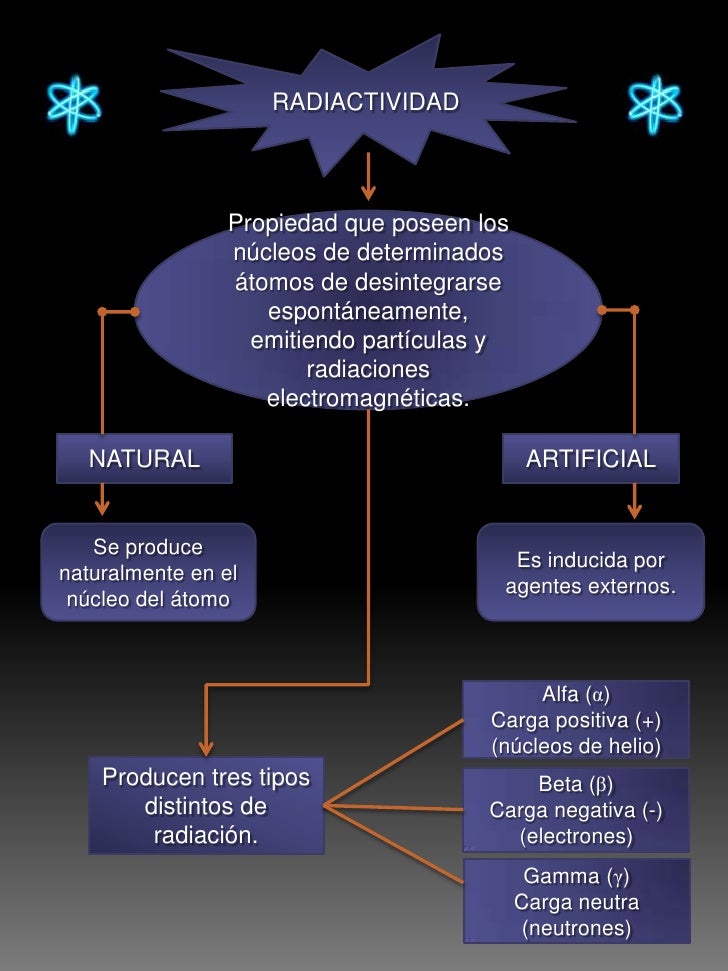
Deber; aplicaciones
.
.


LECTURA OBLIGATORIA PARA REALIZAR TRABAJO COOPERATIVO, CONSTRUIR SU CARTEL Y SUSTENTAR LA EXPOSICIÓN
EL
ÁTOMO NUCLEAR
Se define el número atómico del
elemento como la cantidad de protones que contiene el
núcleo en uno de sus átomos.La masa atómica es el peso comparado de un núcleo atómico. Su unidad es la u.m.a (unidad de masa atómica) que se define como la doceava parte del peso del carbono –12. Un elemento es él y no otro por su número atómico. Así, el uranio lo es porque tiene 92 protones; si no fuera así dejaría de ser uranio. Sin embargo, un mismo elemento puede tener átomos de distinto número de neutrones. A los núcleos que tienen igual número de protones y distinto el de neutrones se les denominas isótopos. La existencia de isótopos de un mismo elemento es una razón por la que los pesos atómicos expresados en las tablas químicas no son números enteros.
Una anotación aceptada para indicar el número y la masa atómica de un núcleo es colocando la masa atómica en la parte superior izquierda del símbolo del elemento, y el número atómico en la inferior izquierda.
El número que indica la masa atómica se representa por A mayúscula y el que indica el número atómico se representa por una Z mayúscula.
Únicamente ciertas combinaciones de Z y A forman núcleos estables: si hay demasiados neutrones, o demasiados pocos, el núcleo sufrirá más pronto o más tarde un cambio, una desintegración radiactiva, que la llevará a la estabilidad en uno o varios pasos. El grado de es inestabilidad se pone de manifiesto por la energía emitida en la desintegración, así como en la velocidad de ésta. Tal velocidad de desintegración se mide por la vida media o período de semidesintegración, que es el tiempo necesario para que el número de átomos inicialmente presente se reduzca a la mitad por desintegración. Los tiempos de semidesintegración varían desde fracciones de segundo hasta millones de años. La desintegración radiactiva puede tener lugar de varias maneras diferentes.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
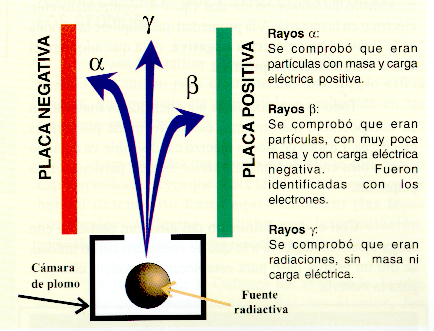
Desintegración Alfa
Un núcleo demasiado pesado para ser estable expulsa un grupo compacto (una partícula alfa), consistente en dos protones, y dos neutrones, que deja al núcleo con una A cuatro unidades menor y una Z dos unidades más bajas, es decir, dos pasos atrás en la tabla periódica. Estructuralmente una partícula alfa es idéntica a un núcleo de Helio – 4. la desintegración alfa es frecuente entre los elementos naturales más pesados (uranio, polonio, y radio, por ejemplo), pero no conduce directamente a núcleos estables: antes se producen isótopos intermedios que experimentan nuevas desintegraciones.
Las partículas alfa tienen una energía de hasta 5.000.000 de electrovoltios, pero son tan voluminosas que sólo pueden atravesar unos 25 mm de aire y se ven detenidas por una simple hoja de papel o por la parte más externa de la piel humana. Sin embargo, por esta misma razón produce serios daños en el interior del cuerpo humano cuando son emitidas por materiales alfa – activos absorbidos inadvertidamente como polvo transportado por el aire, o través de heridas contaminadas. Los emisores naturales de partículas alfa, como el radio, son de uso práctico limitado, ahora que se dispone libremente de gran variedad de radioisótopos artificiales. No obstante, el uranio y su subproducto artificial, el plutonio (otro emisor alfa), son ambos fisibles y, por lo tanto, de importancia primordial en la producción de energía nuclear.
Desintegración Beta
Es un núcleo con demasiados neutrones, uno de estos puede transformarse en un protón más un electrón, que es expulsado en el núcleo. El electrón emitido de esta forma recibe el nombre de partícula β. El núcleo queda con una carga positiva más, con su Z en una unidad más alta y, por lo tanto, un lugar más arriba en la tabla periódica. Las partículas β son capaces de penetrar varios metros de aire, unos cuantos centímetros de tejido corporal o varios mm de metal o de plástico (que proporcionan un apantallamiento adecuado). Puede producir serias quemaduras superficiales o importantes daños internos sobre todo si son emitidos dentro del cuerpo durante periodos de tiempo algo prolongados. La desintegración β es el tipo mas frecuente de desintegración radiactiva tanto entre los isótopos artificiales como entre productos radiactivos procedentes de la desintegración alfa. Algunos de los radioisótopos artificiales obtenidos en aceleradores de partículas o separados en los productos de fisión formados en reactores nucleares tienen pocos neutrones, en lugar de demasiados. Estos se desintegran emitiendo positrones (partículas como los electrones pero cargadas positivamente), que se neutralizan casi de inmediato con los electrones ordinarios para producir una "radiación de aniquilación", con las cualidades de los rayos gamma. Los isótopos que emiten positrones tienen aplicaciones en diagnosis médica.
Emisión de rayos gamma
Esta emisión tiene lugar siempre que la desintegración beta no ha disipado suficiente energía para dar completa estabilidad al núcleo. Muchos isótopos naturales y artificiales con actividad alfa y beta son también emisores de rayos gamma. Los rayos gamma son una radiación electromagnética como los rayos X. Su intensidad se reduce al pasar a través de la materia en un grado que dependerá de su propia energía y de la densidad física del material absorbente. Los rayos gamma no son detenidos como las partículas alfa o beta, ni existen materiales opacos a ellos, como en el caso de la luz. Pueden necesitarse entre 5 y 25 centímetros de plomo o hasta 3 m de hormigón para conseguir una protección adecuada contra los rayos gamma de alta energía. El exceso de radiación gamma externa puede causar graves daños internos al organismo humano, peor no puede inducir radioactividad en él, ni en ningún otro material.
Otras formas de desintegración radiactiva son la transformación interna, en al que una reorganización interior del núcleo da como resultado la emisión de rayos X, o la captura de electrones, en la que un núcleo con demasiados protones captura un electrón de una orbita interna del propio átomo, convirtiendo así un protón en un neutrón, con emisión de rayos X y descenso de un lugar en la tabla periódica los núcleos de uranio – 235 y del U – 238 (emisores de partículas alfa), se desintegran alguna que otra vez por fisión nuclear espontánea, produciendo cualquier par de una gama de posibles núcleos de fisión, además de neutrones libres. El radioisótopo artificial californio – 252 se desintegra exclusivamente por fisión espontánea, proporcionando u8na fuente utilizable de neutrones. Unos pocos isótopos producto de fisión, en particular el yodo – 122, se desintegran con emisión retardada de neutrones poco después de haber sido formados y desempeñan un importante papel en el control de reactores.
La forma de desintegración, los tiempos de semidesintegración y las energías de emisión (energía máximas en el caso de partículas alfa y beta) son, en conjunto, características especificas que distinguen a un isótopo determinado y se pueden emplear para la identificación y medida de los propios emisores y, por tanto, de sus precursores, mediante la técnica de análisis por activación.
La velocidad de desintegración de un isótopo puede caracterizarse mediante una constante denominada período de semidesintegración, que se define como el espacio de tiempo que debe transcurrir que una determinada masa de isótopo se hayan desintegrado la mitad de los átomos que la forman. Esta constante tiene carácter estadístico, ya que es imposible predecir en que momento se va a producir la desintegración de un determinado átomo.
Otra constante que también se utiliza es la vida media que se define como el valor medio de la vida de los átomos del isótopo. No deben confundirse ambos conceptos, ya que ha menudo se utilizan de forma errónea.
Se entiende por fisión, la división de un núcleo muy pesado en un par de núcleos de masa próxima a 60, proceso en el cual se libera gran cantidad de energía
A finales de 1938, O.Hann y F. Strassmann descubrieron en uranio bombardeado con neutrones, la presencia del radioisótopo 139Ba, formado necesariamente por escisión del núcleo de uranio. Este proceso se denominó Fisión nuclear.
Según el modelo de la gota líquida, la fisión se produce porque al captar un neutrón, el núcleo oscila y se deforma, con lo que pierde su forma esférica adquiriendo la figura de un elipsoide entre cuyos extremos se produce una repulsión electrostática que puede llegar a provocar la rotura del núcleo pesado en dos fragmentos. En el caso del uranio-235, los fragmentos que se forman son núcleos de masas próximas a 95, el menor, y a 139, el mayor. Una reacción de fisión típica es:
235 1 90 144 1
29 0 38 54 0
Puesto que la relación neutrones/ protones es
más elevada en el uranio que en los dos núcleos
formados en la fisión, quedan dos neutrones en exceso que
se liberan con gran energía. Si estos neutrones no son
captados por núcleos de otros elementos y no escapan de la
masa escindible, pueden provocar nuevas fisiones, siempre y
cuando se hayan convertido en neutrones lentos mediante
moderadores. Se logra así un proceso auto
sostenido.La energía liberada en la fisión de 1 g de uranio-235 es del orden de 108 kJ, es decir unos dos millones de veces la energía que se obtiene por combustión de 1 g de petróleo.
El primer reactor nuclear fue construido por Fermi en 1942, utilizando grafito como moderador. Así, los neutrones liberados al escindirse un núcleo de uranio-235 provocaban la escisión de nuevos núcleos de uranio-235 o la transmutación del uranio-238 en plutonio-239, que es así mismo fisionable.
En las bombas atómicas de fisión, la explosión se produce al unir dos masas de material fisionable de tamaño inferior al crítico. Es decir, que el recorrido medio que debe atravesar un neutrón liberado, en una fisión espontánea para provocar una nueva fisión, es mayor que el diámetro de esas masas. Al unirlas, se supera el tamaño crítico, con lo que se produce una reacción en cadena.
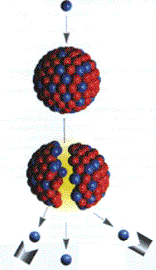
Además de en la fisión de núcleos de átomos pesados, también se libera energía en la formación de núcleos intermedios a partir de núcleos muy ligeros, por ejemplo, de deuterio, 21H, y de tritio, 31H. Este proceso se conoce como fusión nuclear.
Una reacción de fusión típica es la unión de un núcleo del deuterio y uno de tritio para dar un núcleo de Helio y un neutrón:
2 3 4 1
1 1 2 0
Por gramo de combustible, esta reacción comporta
la liberación de tres o cuatro veces más
energía que una reacción de fisión. La
energía liberada corresponde a la diferencia de masa entre
el núcleo formado y sus constituyentes.Las reacciones de fusión son las responsables de la energía que emiten el Sol y las estrellas, en cuyo interior la temperatura es del orden de 20 millones de grados y los átomos de hidrógeno están completamente ionizados. La energía emitida por el Sol equivale a la pérdida de una masa de 4,3 millones de toneladas en un segundo.
A diferencia de lo que ocurre con la fisión, los productos que se forman en las reacciones de fusión no son radiactivos y, además, los isótopos ligeros necesarios para la fusión son comunes (por ejemplo el deuterio existe en el mar), de ahí las grandes esperanzas depositadas en llegar a producir energía a partir de un proceso de fusión. El problema más importante planteado estriba en que los núcleos que se fusionan deben poseer suficiente energía para vencer las fuerzas electrostáticas de repulsión, lo que exige temperaturas de millones de grados. El material se hallará así en estado de plasma, y este plasma debe confinarse durante un tiempo suficientemente largo en un volumen no muy grande para que se produzca una reacción auto sostenida.
En las bombas termonucleares (bombas de hidrógeno) la temperatura necesaria se alcanza mediante la explosión de una o más bombas atómicas que actúan como detonantes de la fusión subsiguiente.

USOS
DE LA RADIACTIVIDAD
El
trazado isotópico en biología
y en medicina
Los diferentes isótopos de un
elemento tienen las mismas propiedades químicas. El reemplazo de uno por otro
en una molécula no modifica, por consiguiente, la función
de la misma. Sin embargo, la radiación emitida permite detectarla, localizarla,
seguir su movimiento
e, incluso, dosificarla a distancia. El trazado isotópico ha permitido estudiar
así, sin perturbarlo, el funcionamiento de todo lo que tiene vida, de la célula
al organismo entero. En biología, numerosos adelantos realizados en el
transcurso de la segunda mitad del siglo XX están vinculados a la utilización
de la radioactividad: funcionamiento del genoma (soporte de la herencia),
metabolismo
de la célula,
fotosíntesis,
transmisión de mensajes químicos (hormonas,
neurotransmisores) en el organismo.
Los isótopos radioactivos se
utilizan en la medicina
nuclear, principalmente en las imágenes
médicas, para estudiar el modo de acción de los medicamentos, entender el
funcionamiento del cerebro,
detectar una anomalía cardiaca, descubrir las metástasis cancerosas.
Las
radiaciones y la radioterapia
Las radiaciones ionizantes pueden
destruir preferentemente las células
tumorales y constituyen una terapéutica eficaz contra el cáncer, la
radioterapia, que fue una de las primeras aplicaciones del descubrimiento de la
radioactividad.
En Francia,
entre el 40 y el 50% de los cánceres se tratan por radioterapia, a menudo
asociada a la quimioterapia o la cirugía. La radioactividad permite curar un
gran número de personas cada año.
Las diferentes formas de
radioterapia:
- La curioterapia, utiliza pequeñas fuentes radioactivas (hilos de platino - iridio, granos de cesio) colocados cerca del tumor.
- La tele radioterapia, consiste en concentrar en los tumores la radiación emitida por una fuente exterior.
- La inmunorradioterapia, utiliza vectores radio marcados cuyos isótopos reconocen específicamente los tumores a los que se fijan para destruirlos.
La
esterilización
La irradiación
es un medio privilegiado para destruir en frío los microorganismos: hongos,
bacterias,
virus...
Por esta razón, existen numerosas aplicaciones para la esterilización de los
objetos, especialmente para el material médico-quirúrgico.
La
protección de las obras de arte
El tratamiento mediante rayos gamma
permite eliminar los hongos, larvas, insectos o bacterias alojados en el
interior de los objetos a fin de protegerlos de la degradación. Esta técnica se
utiliza en el tratamiento de conservación y de restauración de objetos de arte,
de etnología, de arqueología.
La elaboración de materiales. La
irradiación provoca, en determinadas condiciones, reacciones
químicas que permiten la elaboración de materiales más ligeros y más
resistentes, como aislantes, cables eléctricos, envolventes termo retractables,
prótesis,
etc.
La radiografía industrial X o g, Consiste
en registrar la imagen
de la perturbación de un haz de rayos X o g provocada por un objeto. Permite
localizar los fallos, por ejemplo, en las soldaduras, sin destruir los
materiales.
Los detectores de fugas y los indicadores
de nivel, la introducción
de un radioelemento en un circuito permite seguir los desplazamientos de un
fluido, detectar fugas en las presas o canalizaciones subterráneas.
El nivel de un líquido dentro de
un depósito, el espesor de una chapa o de un cartón en curso de su fabricación,
la densidad de un producto químico dentro de una cuba...
pueden conocerse utilizando indicadores radioactivos.
Los detectores de incendio.- Una pequeña fuente radioactiva
ioniza los átomos de oxígeno
y de nitrógeno contenidos en un volumen reducido de aire. La llegada de
partículas de humo modifica esta ionización. Por esta razón se realizan y se
utilizan en los comercios, fábricas, despachos... detectores radioactivos
sensibles a cantidades de humo muy pequeñas.
Las pinturas luminiscentes
Se trata de las aplicaciones más
antiguas de la radioactividad para la lectura
de los cuadrantes de los relojes y de los tableros de instrumentos para la
conducción de noche.
La alimentación de energía de los satélites
Las baterías eléctricas funcionan
gracias a pequeñas fuentes radioactivas con plutonio 239, cobalto 60 o
estroncio 90. Estas baterías se montan en los satélites
para su alimentación energética. Son de tamaño muy reducido y pueden funcionar
sin ninguna operación de mantenimiento
durante años.
La
producción de electricidad
Las reacciones en cadena de
fisión del uranio se utilizan en las
centrales nucleares que, en Francia, producen más del 75% de la electricidad.
SECUENCIA
1. El
ciclo del combustible nuclear
En un reactor, la fisión del
uranio 235 provoca la formación de núcleos radioactivos denominados productos
de fisión. La captura de neutrones por el uranio 238 produce un poco de
plutonio 239 que puede proporcionar también energía por fisión.
Sólo una ínfima parte del
combustible colocado en un reactor se quema en la fisión del núcleo. El
combustible que no ha sido consumido y el plutonio formado se recuperan y se
reciclan para producir de nuevo electricidad. Los otros elementos formados en
el transcurso de la reacción se clasifican en tres categorías de residuos en
función de su actividad, para ser embalados y luego almacenados.


2. La seguridad
nuclear
La utilización de la fantástica
fuente de energía contenida en el núcleo de los átomos implica el respeto
riguroso de un conjunto de reglas de seguridad nuclear que permita asegurar el
correcto funcionamiento de las centrales nucleares y la protección de la población.
3. Los residuos nucleares
Toda clase
de actividad humana genera residuos. La industria
nuclear no es una excepción a esta regla. Francia produce, de promedio, por año
y por habitante:
- 5.000 Kg de residuos, de los cuales
- 100 Kg de residuos tóxicos, que incluyen
- 1 Kg de residuos nucleares de los cuales
- 5 gr de residuos son de alta actividad.
No sabemos aún destruir los
residuos radioactivos. Su actividad disminuye naturalmente en el tiempo, más o
menos rápido en función de su período. Deben utilizarse, por consiguiente, técnicas
de confinamiento y de almacenamiento.
La reducción del volumen y de la
actividad de los residuos radioactivos es, en Francia, un objetivo
prioritario para la
investigación. La amplitud del comportamiento
a largo plazo de los residuos acumulados también es un eje primordial en la
investigación
Al estudiar los tipos de
radiación que se emiten a partir del núcleo de un isótopo radiactivo nos
encontramos con la emisión de tres partículas. Una de ella es la partícula
alfa; en este caso, el número atómico del átomo original disminuye en dos y el
número de masa disminuye en cuatro unidades; Otro es el caso de las partículas
beta, donde el número atómico del núcleo original disminuye en una unidad y el
número de masa no cambia y por último la radiación gamma, de alta energía, que
carece de carga y masa, podemos concluir que con frecuencia se emiten junto con
las partículas alfa o beta cuando un núcleo regresa a un estado más estable en
contraste con los rayos X, y que se produce durante ciertas transiciones
electrónicas entre distintos niveles de energía.
Cuando se desintegra un isótopo
de un elemento se produce un isótopo de un elemento distinto; es decir, un tipo
de átomo se transforma en otro. Una ecuación nuclear representa los cambios
ocurridos y al balancearla, la suma de los números de masa de las partículas de
cada lado de la ecuación deben ser iguales, y también deben serlo las sumas de
las cargas nucleares.
Cuando se bombardean con
neutrones con la energía apropiada, ciertos núcleos sufren una fisión, este
proceso libera grandes cantidades de energía y se reúne cierta cantidad mínima
(masa crítica)
de un isótopo fisionable lo que puede desencadenar una reacción en cadena
autosustentable al quedar algún neutrón. En una bomba de fisión (bomba atómica)
la reacción en cadena avanza sin control, por esto sus consecuencias.
Durante la fusión nuclear se unen
núcleos pequeños, como deuterio y tritio. Las
reacciones de este tipo liberan más energía que las reacciones de fisión. La
fusión nuclear no regulada ocurre en el sol y en las bombas de hidrógeno. La
fusión nuclear regulada no se ha logrado, pero las investigaciones
prosiguen.
La cantidad de electricidad que
se puede generar a partir de las reservas mundiales de Uranio y de otros
combustibles nucleares depende mucho de los tipos de reactores nucleares que se
construyan. Un tipo de reactor es el supprregeneradores que puede producir una
60 veces más de energía que la que el mismo combustible generaría en un reactor
térmico de los que actualmente se construyen. Sin reactores supprregeneradores,
que aún han de desarrollarse a nivel comercial, el mundo sufriría escasez
de Uranio dadas las fuentes actuales en un lapso de 40 años.
La energía geotérmica procede del
calor
almacenado en el interior de la tierra.
La mayor parte de él se produjo y aun se produce por la lenta desintegración de
elementos radioactivos que existen de modo natural en todas las rocas.
La producción energética de todas las centrales geotérmicas equivale
aproximadamente a la producción en un solo reactor nuclear grande.
La química nuclear ha adquirido
una importancia extrema en medicina y ha hecho aportes considerables a la agricultura
y la industria, e incluso a nuestra vida cotidiana. Es difícil que algunas
facetas de la vida humana no hayan sido tocadas por los desarrollos en la ciencia
nuclear. Los eventos
históricos con relación a este tema nos muestra
que el conocimiento
no está limitado a una nación
o grupo y cuando personas de diversa formación trabajan en colaboración, es
mucho lo que se puede lograr. Además, la ciencia
no se sostiene por sí sola: la solución de los problemas
de la época actual depende de la capacidad del hombre
para combinar la ciencia, la política, los negocios
y los valores
humanos.
- ENCICLOPEDIA SALVAT "CÓMO FUNCIONA". Radioactividad, átomo nuclear,
desintegración alfa, beta y gamma.
Director Juan Salvat
Volumen IX Pue-Te Salvat Editores, S.A
Leer más: http://www.monografias.com/trabajos16/radiactividad/radiactividad.shtml#USOS#ixzz4AZZUpRAP
https://prezi.com/0rgli3goqhdj/la-radioactividad-en-el-cancer/
TU PREGUNTA PARA EXAMEN:
Reconoce el origen de la radiactividad y el aporte de científicos
sobresalientes sobre el tema.
- Lee, razona y elabora un organizador grafico sobre el origen de la radiactividad.
La radiactividad fue descubierta en 1896 por el químico
francés Becquerel durante sus estudios sobre la fluorescencia. Observó que una
placa fotográfica no expuesta a la luz y envuelta en papel negro era
impresionada como por la luz visible o ultravioleta (o por los rayos
X recientemente descubiertos por Röntgen), cuando el paquete se ponía en
contacto con compuestos del elemento pesado uranio. Dedujo (correctamente) que
este elemento debía producir algún tipo de radiación la cual atravesaba el
papel hasta alcanzar y afectar a la emulsión fotográfica. Un cuidadoso estudio
emprendido por Becquerel y otros científicos, entre ellos los Curie, Joliot,
Soddy, Rutherford, Chadvick y Geiger, reveló que cierto número de elementos
químicos pesados (muchos de ellos no descubiertos antes a causa de su rareza)
parecían ser interiormente inestables y daban a origen a radiaciones
penetrantes. Con ello, esos mismos elementos se transformaban en otros
diferentes, siguiendo caminos complicados, pero bien definidos, en busca de una
estabilidad final. Este fenómeno totalmente distinto de cualquier otro
estudiado hasta entonces, recibió el nombre de radiactividad, y el proceso de transformación fue llamado desintegración radiactiv




.
Fusión Nuclear 2100 Energía del futuro ITER Tokamak EFDA
,,
Fusión en una cápsula de oro.
.
VIDEOS BOMBA DE HIDRÓGENO
OBSERVE Y ELABORE INFORME 1
VIDEOS RADIACTIVIDAD
OBSERVE Y ELABORE INFORME 1
Videos para motivar 1,2
Elabora tu resumen e
incluye en tu resuen los organizadores gráficos. video 3
.
.
.
%%%%%%%%%%%%%%%%%%%%%%%%%%%%
%%%%%%%%%%%%%%%%%%%%%%%
experimentos
.
.
.
.
.
.
,
EL TRANSPORTE DE MATERIAL RADIACTIVO INTERNACIONAL
,
BOQUE 5
Prepara tu examen.
3.- Comprueba
la ley de conservación de masas. (Ca: 40g; O;16g; H;1g)
A. Tema 1.- CaO + H2O
= Ca(OH)2
TEMA 2.- NaHCO3 + calor = CO2 + CaO + H2O
TEMA 2.- NaHCO3 + calor = CO2 + CaO + H2O
OBSERVA EL VIDEO, RELACIONA CON LAS PRACTICAS OBSERVADAS Y RESPONDE EL SIGUIENTE CUESTIONARIO DE TU LECCIÓN
- En un OG clasifica los tipos de reacciones químcas
- La descomposición del clorato de potasio, a que tipo de rección pertenece, recuerda la hizimos en el laboratorio. descríbela
- Describe a que clase de reacción pertenece la reacción del hierro en polvo y el acido nítrico, describe, formula y balancea la ecuación.
- Cual de las practicas realizadas te gusto más, explica por qué.
&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&
&&&&&&&&&&
,
,
Educar a un joven no es hacerle aprender algo que no sabía, sino hacer de él alguien que no existía. John Ruskin
DEBER
PARA SU CARPETA
PRESENTAR LOS INFORMES DE CADA UNA DE LAS PRÁCTICAS REALIZADAS EN EL LABORATORIO:
REACCIONES QUÍMICAS
R1:
R2
R3
R4
SIGA EL FORMATO DE INFORME CORRESPONDIENTE
(trabajos copiados serán anulados)
DEBER
PARA SU CUADERNO DE MATERIA
entrega semana del 18 al 22 de abril.
se receptaran deberes rezagasos hasta el míercoles 27Formular e igualar por uno de los metodos: redox, ión electrón las siguientes ecuaciones químicas.
1.
Acido níttico más ácido bromhídrico produce bromo molecular más monóxido de nitrógeno más
agua.
HNO3 + HBr--------Br 2 + NO + H2O
HNO3 + HBr--------Br 2 + NO + H2O
2.
Zinc más nitrato de potasio más ácido sulfúrico
producen sulfato de zinc más sulfato de amonio más sulfato de potasio más agua.
----------------------------------------------------------------------------
----------------------------------------------------------------------------
3.
Permanganato de potasio más anhídrido sulfuroso más agua produce sulfato
ácido de potasio más sulfato manganoso más ácido sulfúrico.
kMnO4 + SO2 + H2O ----KHSO4 + MnSO4 + H2SO4
kMnO4 + SO2 + H2O ----KHSO4 + MnSO4 + H2SO4
4.
Zinc atómico más hidróxido de sodio más nitrato
de sodio producen cincato de sodio más
amoniaco más agua
Zn + NaOH + NaNO3 --------- Na2ZnO2 +NH3 + H2O
5.
Sulfuro crómico más nitrato manganoso más
carbonato de sodio producen monóxido de nitrógeno más dióxido de carbono
más cromato de sodio más manganato de sodio más
sulfato de sodio.
Cr2S3 +Mn(NO3)2 + Na2 CO3...........NO + CO2+Na2 CrO4 + Na2MNO4 + Na2SO4
Cr2S3 +Mn(NO3)2 + Na2 CO3...........NO + CO2+Na2 CrO4 + Na2MNO4 + Na2SO4
Balanceo oxido-reducción
Este método se basa en analizar por separado dos reacciones que
son las reacciones de oxidación y las reacciones de reducción, las
cuales se balancean y una vez estén balanceadas se suman con el fin de
obtener la ecuación final balanceada, para lograr balancear por este
método se deben seguir los siguientes pasos:
- Escriba la ecuación a balancear
- Escriba los estados de oxidación de todos los elementos que tiene la reacción.
- Escriba los elementos que cambian de estado de oxidación mostrando su estado de oxidación antes y después de la reacción.
- Se determina el elemento que gana electrones en la reacción y luego se escribe una reacción química con el elemento en cuestión, esta seria la semireacción de reducción.
- Se determina el elemento que pierde electrones en la reacción y luego se escribe una reacción química con el elemento en cuestión, esta seria la semireacción de oxidación.
- Balancee la semireacción de reducción.
- Balancee la semireacción de oxidación.
- Balancee las cargas en las semireacciones de oxidación y reducción.
- Todas las especies químicas que hay en la semireacción de reducción deben multiplicarse por el número de electrones que hay en la semireacción de oxidación y viceversa es decir todas las especies químicas que hay en la semireacción de oxidación deben multiplicarse por el número de electrones que hay en la semireacción de reducción.
- Sume las dos semireacciones.
- Si en ambos lados de la ecuación se encuentran especies químicas iguales se anulan la misma cantidad de esta especie a lado y lado de la ecuación hasta que en alguno de los lados no haya más de esta especie química en cuestión que cancel.
- Simplifique la ecuación química lo mas posible.
- Verificar si la ecuación química quedo balanceada tanto en cargas como en masa.
- Se trasladan los coeficientes a la ecuación original.
- Verificar el balanceo y en caso encontrarse diferencias se realiza un pequeño tanteo.
- Cr2(SO4)3 + KOH +KClO3 → K2CrO4 + H2O + KCl + K2SO4
- Cr2+3(S+6O4–2)3 + K+1O-2H+1 + K+1Cl+5O3-2 →K2+1Cr+6O4-2 + H2+1O-2 + K+1Cl-1 + K2+1S+6O4-2
- Cr+3 → Cr+6 Cl+5 → Cl–
- Cl+5 → Cl– Reacción de reducción
- 2Cr+3 → Cr+6 Reacción de oxidación
- Cl+5 → Cl– Esta semireacción tiene balanceado el cloro así que no se hace nada
- 2Cr+3 → Cr+6 Se balancea esta semireacción de la siguiente manera . 2Cr+3 → 2Cr+6
- Cl+5 + 6e–→Cl– Balanceadas las cargas de la semireacción de reducción. . 2Cr+3→2 Cr+6 + 6e– Balanceadas las cargas de la semireacción de oxidación
- 6Cl+5 + 36 e– → 6 Cl– 12Cr+3 → 12 Cr+6 + 36 e–
- 6Cl+5 + 36e–+ 12Cr+3 → 6Cl– + 12Cr+6 + 36 e–
- 6 Cl+5 + 12 Cr+3→ 6 Cl– + 12 Cr+6
- Cl+5 + 2 Cr+3→ Cl– + 2 Cr+6
- Cr2(SO4)3 + KOH + KClO3 → 2 K2CrO4 + H2O +KCl + K2SO4
- Esta ecuación no se encuentra balanceada totalmente así que se realiza un balanceo por tanteo para terminar obteniéndose la siguiente ecuación plenamente balanceada. Cr2(SO4)3 + 10KOH +KClO3 → 2 K2CrO4 + 5H2O +KCl + 3K2SO4
PROBLEMAS PARA RESOLVER
roblema: Ajusta la siguiente reacción redox en medio ácido:
Na2SO4 + C → CO2 + Na2S
Problema: Ajusta la siguiente reacción redox en medio ácido:
HCl + K2Cr2O7 → Cl2 + CrCl3 + KCl
Problema: Ajusta la siguiente reacción redox en medio ácido:
Cr2O72− + SO32− → Cr3+ + SO42−
Problema: Ajusta la siguiente reacción redox en medio ácido:
KMnO4 + HCl → Cl2 + MnCl2 + KCl
Problema: Ajusta la siguiente reacción redox en medio ácido:
KMnO4 +
FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4
Problema: Ajusta la siguiente reacción redox en medio ácido:
H2O2 + HI → I2 + H2O
Problema: Ajusta la siguiente reacción redox en medio ácido:
K2Cr2O7 +
FeSO4 + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + H2O + K2SO4
Problema: Ajusta la siguiente reacción redox en medio ácido:
Cr2O72− + C2O42− → Cr3+ + CO2
Problema: Ajusta la siguiente reacción redox en medio
básico:
KMnO4 + KNO2 + H2O → MnO2 + KNO3 + KOH
Problema: Ajusta la siguiente reacción redox en medio
básico:
N2O4 + Br− → NO2− + BrO3−
Problema : Ajusta la siguiente reacción redox en medio
básico:
Cr(OH)3 + KIO3 → KI + K2CrO4
Problema : Ajusta la siguiente reacción redox en medio
básico:
KI + KClO3 → I2 + KCl + KOH
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%