Postulados de Bohr
En 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales:1
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
La causa de que el electrón no irradie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica una carga con un movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercial, deben ser iguales en magnitud en toda la órbita. Esto nos da la siguiente expresión:
- Donde el primer término es la fuerza eléctrica o de Coulomb, y el segundo es la fuerza centrífuga; k es la constante de la fuerza de Coulomb, Z es el número atómico del átomo, e es la carga del electrón,
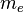 es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
En la expresión anterior podemos despejar el radio, obteniendo:
Y ahora con ésta ecuación y sabiendo que la energía total es la suma de las energías cinética y potencial:
- Donde queda expresada la energía de una órbita circular para el electrón en función del radio de dicha órbita.
Segundo postulado
No toda órbita para electrón está permitida, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular,  , del electrón sea un múltiplo entero de
, del electrón sea un múltiplo entero de 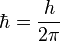 Esta condición matemáticamente se escribe:
Esta condición matemáticamente se escribe:
 , del electrón sea un múltiplo entero de
, del electrón sea un múltiplo entero de 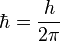 Esta condición matemáticamente se escribe:
Esta condición matemáticamente se escribe:- con
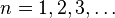
A partir de ésta condición y de la expresión para el radio obtenida antes, podemos eliminar  y queda la condición de cuantización para los radios permitidos:
y queda la condición de cuantización para los radios permitidos:
 y queda la condición de cuantización para los radios permitidos:
y queda la condición de cuantización para los radios permitidos:- con
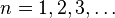 ;
subíndice introducido en esta expresión para resaltar que el radio
ahora es una magnitud discreta, a diferencia de lo que decía el primer
postulado.
;
subíndice introducido en esta expresión para resaltar que el radio
ahora es una magnitud discreta, a diferencia de lo que decía el primer
postulado.
Ahora, dándole valores a  , número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
 , número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:- expresando el resultado en ångström.
Del mismo modo podemos ahora sustituir los radios permitidos 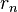 en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
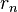 en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
Igual que antes, para el átomo de Hidrógeno (Z=1) y el primer nivel permitido (n=1), obtenemos:
- que es la llamada energía del estado fundamental del átomo de Hidrógeno.
Y podemos expresar el resto de energías para cualquier Z y n como:
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de una
órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya
energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:
- donde
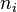 identifica la órbita inicial y
identifica la órbita inicial y 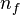 la final, y
la final, y 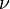 es la frecuencia.
es la frecuencia.
Entonces las frecuencias de los fotones emitidos o absorbidos en la transición serán:
A veces, en vez de la frecuencia se suele dar la inversa de la longitud de onda:
Ésta última expresión fue muy bien recibida porque explicaba teóricamente la fórmula fenomenológica hallada antes por Balmer para describir las líneas espectrales observadas desde finales del siglo XIX en la desexcitación del Hidrógeno, que venían dadas por:
- con
 , y donde
, y donde 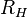 es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso
es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso  , es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (
, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg ( ), coincide con el valor de la fórmula teórica.
), coincide con el valor de la fórmula teórica.
Se puede demostrar que este conjunto de hipótesis corresponde a la
hipótesis de que los electrones estables orbitando un átomo están
descritos por funciones de onda estacionarias. Un modelo atómico es una
representación que describe las partes que tiene un átomo y como están
dispuestas para formar un todo. Basándose en la constante de Planck 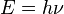 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
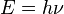 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.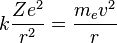



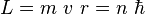




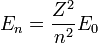



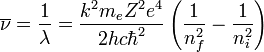

No hay comentarios:
Publicar un comentario
TUS COMENTARIOS SON MUY ÚTILES PARA MEJORAR LA CONSTRUCCIÓN DE ESTE CITIO.