UNIDAD 9
COMPOSICIÓN CUANTITATIVA
Composicion Porcentual de un Compuesto No. 1
Ejemplo con la sacarosa C12H22O11 y sulfato de ppotasió K2SO4
Cap 7 Parte 4 Cuantos atomos de magnesio Mg hay en 5,00g
%%%%%%%%%%%%%%%%%%%%%%%
UNIDAD 8.
Resumen sales
ANHIDRIDO
|
ÁCIDO OXACIDO
|
 OXISAL NEUTRA OXISAL NEUTRA |
NO METAL + OXÍGENO
|
ANHÍDRIDO + AGUA
|
ÁCIDO OXACIDO + HIDRÓXIDO
|
S+O=SO
S+O=SO2
S+O=SO3
|
SO+H2O=H2SO2
SO2+H2O=H2SO3
SO3+H2O=H2SO4
|
H2SO2+Ca(OH)2=Ca
SO2+2H2O
H2SO3+Ca(OH)2=Ca
SO3+2H2O
H2SO4+Ca(OH)2=Ca
SO4+2H2O
|
SO3
ÁHNIDRIDO HIPOSULFURSO
|
H2SO2
ÁCIDO HIPOSULFURSO
|
Ca SO2
HIPOSULFITO
DE CALCIO
|
https://www.youtube.com/watch?v=HxfklPOAoVU&index=4&list=PLZrSlIPwhovzrgB_qVRXwrBl20xgIx14b
PARA REFUERZO
N-3 Nitruro
NO2-1 Nitrito
NO-1 Nitrato
P-3 Fosfuro
PO3-3 Fosfito
PO4-3 Fosfato
HPO4-2 Fosfato acido
H2PO4-1 Fosfato diacido
AsO3-3 Arsenito
AsO4-3 Arseniato
O-2 Oxido
O2-2 Peroxido
OH-1 Hidroxido
S-2 Sulfuro
HS-1 Sulfuro acido
SO4-2 Sulfato
SO3-2 SulfitoHSO3-1 Sulfito acido
HSO4-1 Sulfato acido
SCN-1 Sulfucianuro
F-1 Floruro
Cl-1 Cloruro
Br-1 Bromuro
I-1 Yoduro
ClO-1 Hipoclorito
ClO2-1 Clorito
ClO3-1 Clorato
ClO4-1 Perclorato
CrO4-1 Cromato
CrO7-2 Dicromato
MnO4-2 Manganato
MnO4-1 Permanganato
Fe (CN)6-5 Ferricianuro
Fe (CN)6-4= Ferrocianuro
ZnO2-2 Cincato
MoO4-2 Molibdato
TiO4-2 Titanato
H3O+1 Hidronio
NH4+1 Amonio
Casos especiales de los
Oxoácidos
Hay
elementos a los que también se les puede sumar 2 ó 3 moléculas de agua al
óxido. En algunos casos pueden reaccionar 2 moléculas de óxido con una de
agua. Para todos ellos la nomenclatura de Stock y la
estequiométrica no varían, pero la nomenclatura funcional pone
un prefijo para indicar el número de moléculas de agua que se le han añadido
al óxido. Dichos prefijos quedan reflejados en la siguiente tabla:
Oxoácidos
Hay
elementos a los que también se les puede sumar 2 ó 3 moléculas de agua al
óxido. En algunos casos pueden reaccionar 2 moléculas de óxido con una de
agua. Para todos ellos la nomenclatura de Stock y la
estequiométrica no varían, pero la nomenclatura funcional pone
un prefijo para indicar el número de moléculas de agua que se le han añadido
al óxido. Dichos prefijos quedan reflejados en la siguiente tabla:
|
META
PIRO
ORTO
ELEMENTOS
Valencia impar
1, 3, 5
1 de óxido
+
1 de agua
1 de óxido
+
2 de agua
1 de óxido
+
3 de agua
P, As, Sb
Valencia par
2, 4, 6
1 de óxido
+
1 de agua
2 de óxido
+
1 de agua
1 de óxido
+
2 de agua
S, Se, Te
META
|
PIRO
|
ORTO
|
ELEMENTOS
|
|
Valencia impar
1, 3, 5 |
1 de óxido
+ 1 de agua |
1 de óxido
+ 2 de agua |
1 de óxido
+ 3 de agua |
P, As, Sb
|
Valencia par
2, 4, 6 |
1 de óxido
+ 1 de agua |
2 de óxido
+ 1 de agua |
1 de óxido
+ 2 de agua |
S, Se, Te
|
Ej:
Desarrollo y fórmula del ácido
Nombre Tradicional
P2O3 + 2 H2O  H4P2O5
H4P2O5
Ac. Pirofosforoso
P2O5 + 3 H2O  H6P2O8
H6P2O8  H3PO4
H3PO4
Ac. Ortofosfórico o Fosfórico
SO3 + 1
H2O  H2SO4
H2SO4
Ac.
Metasulfúrico o Sulfúrico
2
SO2 + 1 H2O  H2S2O5
H2S2O5
Ac.
Pirosulfuroso
Desarrollo y fórmula del ácido
|
Nombre Tradicional
|
P2O3 + 2 H2O
|
Ac. Pirofosforoso
|
P2O5 + 3 H2O
|
Ac. Ortofosfórico o Fosfórico
|
SO3 + 1
H2O
|
Ac.
Metasulfúrico o Sulfúrico
|
2
SO2 + 1 H2O
|
Ac.
Pirosulfuroso
|
CÓMO SE NOMBRAN UNIVERSALMENTE LOS ÁCIDOS OXÁCIDOS.
Nomenclatura
|
|||
Fórmula
|
Funcional
|
Stock
|
|
HPO2
|
Ac.
Metafosforoso
|
Ac.
Dioxofosfórico(III)
de Hidrógeno |
|
HPO3
|
Ac.
Metafosfórico
|
Ac.
Trioxofosfórico(V)
de Hidrógeno |
Trioxometafosfato de Hidrógeno
|
H4P2O5
|
Ac.
Pirohipofosforoso
|
Ac.
Trioxodifosfórico(I)
de Hidrógeno |
Pentaoxo pirofodfito
de tetra hidrógeno
|
H4P2O5
|
Ac.
Pirofosforoso
|
Ac.
Pentaoxodifosfórico (III)
de Hidrógeno |
Pentaoxo pirofosfito
de tetra hidrógeno
|
H4P2O7
|
Ac.
Pirofosfórico
|
Ac.
Heptaoxofosfórico(V)
de Hidrógeno |
Heptaoxopirofosfato
de tetra Hidrógeno
|
H3PO3
|
Ac.
Ortofosforoso o Fosforoso
|
Ac.
Trioxofosfórico(III)
de Hidrógeno |
Trioxofosfato
de tri Hidrógeno
|
H3PO4
|
Ac.
Ortofosfórico o Fosfórico
|
Ac.
Tetraoxofosfórico(V)
de Hidrógeno |
Tetraoxofosfato
de tri Hidrógeno
|
H2SO2
|
Ac.
Metahiposulfuroso o hiposulfuroso
|
Ac.
Dioxosulfúrico(II)
de Hidrógeno |
Dioxohiposulfito de di Hidrógeno
|
H2SO3
|
Ac.
Metasulfuroso o Sulfuroso
|
Ac.
Trioxosulfúrico(IV)
de Hidrógeno |
Trioxosulfito
de di Hidrógeno
|
H2SO4
|
Ac.
Metasulfúrico o Sulfúrico
|
Ac.
Tetraoxosulfúrico(VI)
de Hidrógeno |
Tetraoxosulfato
de di Hidrógeno
|
NOMENCLATURA-ACIDOS OXACIDOS (NOMBRES Y ESTRUCTURAS DE LEWIS)
La Nomenclatura IUPAC es un sistema de nomenclatura
de compuestos químicos y de descripción la ciencia de la química en
general. Está desarrollado y actualizado bajo el patrocinio de la Unión
Internacional de Química Pura y Aplicada.
Las reglas para nombrar compuestos orgánicos e inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el Libro Verde, describe las recomendaciones para el uso de símbolos para cantidades físicas (en asociación con la IUPAP), mientras que el cuarto, el Libro Dorado, contiene las definiciones de un gran número de términos técnicos usados en química. Una compilación similar existe para la bioquímica (en asociación con el IUBMB), el análisis químico y la química macromolecular. Estos libros están complementados por unas cortas recomendaciones para circunstancias específicas las cuales son publicadas de vez en cuando en la Revista de Química Pura y Aplicada.
SISTEMA DE NOMENCLATURA STOCK Los elementos pueden combinarse de diferente forma. Se conoce como número de oxidación al número de electrones cedidos o captados por un átomo en su combinación química con otro para formar un enlace. Los elementos al reaccionar tienden a perder o ganar electrones. Cuando ganan electrones el número de valencia es negativo, cuando pierden electrones el número es positivo. Un átomo neutral forma un ión, especie con carga cuando pierde o gana electrones. Si pierde electrones se conoce como catión y si gana electrones se conoce como anión. El sistema de nomenclatura Stock trabaja con los elementos que poseen números de oxidación positivos. Ciertos elementos como cobre (Cu), hierro (Fe) y manganeso (Mn), plomo (Pb) poseen diferentes números de oxidación. En el sistema stock se utiliza paréntesis después del símbolo del elemento. Dentro del paréntesis aparece un número romano que indica el número de oxidación del elemento. Si tenemos un
Las reglas para nombrar compuestos orgánicos e inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el Libro Verde, describe las recomendaciones para el uso de símbolos para cantidades físicas (en asociación con la IUPAP), mientras que el cuarto, el Libro Dorado, contiene las definiciones de un gran número de términos técnicos usados en química. Una compilación similar existe para la bioquímica (en asociación con el IUBMB), el análisis químico y la química macromolecular. Estos libros están complementados por unas cortas recomendaciones para circunstancias específicas las cuales son publicadas de vez en cuando en la Revista de Química Pura y Aplicada.
SISTEMA DE NOMENCLATURA STOCK Los elementos pueden combinarse de diferente forma. Se conoce como número de oxidación al número de electrones cedidos o captados por un átomo en su combinación química con otro para formar un enlace. Los elementos al reaccionar tienden a perder o ganar electrones. Cuando ganan electrones el número de valencia es negativo, cuando pierden electrones el número es positivo. Un átomo neutral forma un ión, especie con carga cuando pierde o gana electrones. Si pierde electrones se conoce como catión y si gana electrones se conoce como anión. El sistema de nomenclatura Stock trabaja con los elementos que poseen números de oxidación positivos. Ciertos elementos como cobre (Cu), hierro (Fe) y manganeso (Mn), plomo (Pb) poseen diferentes números de oxidación. En el sistema stock se utiliza paréntesis después del símbolo del elemento. Dentro del paréntesis aparece un número romano que indica el número de oxidación del elemento. Si tenemos un
ÁCIDOS, BASES Y SALES 01
Indicador Casero de Ácido y Base | Home indicator of acid and base
ÁCIDOS Y BASES_USO DIARIO_MUSICALIZADO_COMPLETO.wmv
https://sites.google.com/site/formulacionquimicainorganica/Home/mapa-del-sitio
http://www.lamanzanadenewton.com/materiales/aplicaciones/lfq/lfq_numox01.html
http://diversificacionfernandodelosrios.blogspot.com/2013/04/4-eso-las-formulas-quimicas.html
https://www.youtube.com/watch?v=Nl-d2gGUpeE&list=PLpDHmKMziL2NX8FL6XEDBqggEgTRvb9mv (PRÁCTICAS)
ÓXIDOS BÁSICOS Y ÓXIDOS ÁCIDOS
AUTOEVALUARSE EN .....
http://www.educaplay.com/es/recursoseducativos/898880/anhidridos__oxidos_acidos_.htm#_=_
La cancion de los numeros de oxidacion
Ingrese y trabaje
http://webquest.cepdeorcera.org/wq/ver/1192 Puede también realizar una lectura comprensiva Fórmulas químicas |
|
Para representar una sustancia química
utilizamos las fórmulas químicas,
que nos indican los átomos que la forman así como el número o
proporción de estos átomos en dicha sustancia.
|
|
| El objetivo de la formulación y nomenclatura química es que a partir del nombre de un compuesto sepamos cual es su fórmula, y a partir de la fórmula sepamos cual es su nombre. Antiguamente esto no era tan fácil, pero gracias a las normas de la I.U.P.A.C. (Unión Internacional de Química Pura y Aplicada) la formulación resulta más sencilla. | |
| Porque así consiguen más estabilidad. Cuando se estudian las configuraciones electrónicas de los átomos se ve que los electrones del nivel de valencia (la última capa) tienen una importancia especial ya que son los que participan en la formación de los enlaces y en las reacciones químicas. También estudiaste que los gases nobles tienen gran estabilidad, y eso se debe a que tienen las capas electrónicas completas. Pues bien, tener las capas electrónicas completas será la situación a la que tiendan la mayoría de los átomos a la hora de formar enlaces, o lo que es lo mismo a la hora de formar compuestos. |
|
| Los
átomos pueden conseguir configuración de gas noble de tres formas: ganando, perdiendo o compartiendo electrones con otros átomos. En los elementos de los grupos representativos (alcalinos, alcalinoterreos, grupo del B, grupo del C, grupo del N, calcógenos y halógenos) el nivel de valencia se completa con ocho electrones. Los átomos con pocos electrones de valencia (alcalinos , alcalinotérreos, etc.) tenderán a perderlos dando lugar a iones positivos (cationes) y formando en general compuestos iónicos. Los átomos con muchos electrones de valencia (halógenos, calcógenos, etc.) tenderán a ganarlos dando lugar a iones negativos (aniones), formando con los metales compuestos iónicos, pero con los no metales compuestos covalentes.
|
|
| Los compuestos son eléctricamente
neutros, excepto los iones cuando los formulemos separadamente. Es decir, la carga que
aporten todos los átomos de un compuesto tiene que ser globalmente nula, debemos
tener en un compuesto tantas cargas positivas como negativas. Pero para saber cuál es la carga que aporta cada átomo vamos a emplear un concepto muy útil que se llama número de oxidación. |
|
|
El
número de oxidación es un número entero que representa el
número de electrones que un átomo pone en
juego cuando
forma un compuesto determinado. El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos. El número de oxidación se escribe en números romanos (recuérdalo cuando veamos la nomenclatura de Stock): +I, +II, +III, +IV, -I, -II, -III, -IV, etc. Pero en esta página también usaremos caracteres arábigos para referirnos a ellos: +1, +2, +3, +4, -1, -2, -3, -4 etc., lo que nos facilitará los cálculos al tratarlos como números enteros. En los iones monoatómicos la carga eléctrica coincide con el número de oxidación. Cuando nos refiramos al número de oxidación el signo + o - lo escribiremos a la izquierda del número, como en los números enteros. Por otra parte la carga de los iones, o número de carga, se debe escribir con el signo a la derecha del dígito: Ca2+ ión calcio(2+), CO32- ión carbonato(2-). ¿Será tan complicado saber cuál es el número de oxidación que le corresponde a cada átomo? Pues no, basta con conocer el número de oxidación de los elementos que tienen un único número de oxidación, que son pocos, y es muy fácil deducirlo a partir de las configuraciones electrónicas. Estos números de oxidación aparecen en la tabla siguiente. Los números de oxidación de los demás elementos los deduciremos de las fórmulas o nos los indicarán en el nombre del compuesto, así de fácil. |
|
|||||||||||||||||||||||||||||||||||||
El hidrógeno (H)
presenta número
de oxidación +1 con los no metales y –1 con los metales.
El flúor (F)
sólo presenta el número de
oxidación –1.
El oxígeno (O) presenta el número de oxidación –2, excepto en
los peróxidos donde es –1
Los metales
alcalinos (grupo 1, o grupo del Li) tienen 1 electrón de valencia,
tenderán a perderlo poseyendo siempre en los compuestos número de oxidación +1.
Los metales
alcalinotérreos (grupo 2, o grupo del Be) tienen 2 electrones de valencia,
tenderán a perderlos poseyendo siempre en los compuestos número de oxidación +2.
El grupo del B
(grupo 13) tiene 3 electrones de valencia, tenderán a perderlos poseyendo siempre
en los compuestos número de oxidación +3.
El grupo del C
(grupo 14) tiene 4 electrones de valencia, que tienden a compartirlos,
tienen número de oxidación +4 frente a los no metales, y número de
oxidación –4 frente a los metales y al H.
El grupo del N
(grupo 15) tiene 5 electrones de valencia, tenderán a ganar 3 poseyendo siempre
con el H y conlos metales número de oxidación –3.
Los calcógenos
(grupo 16, o grupo del O) tienen 6 electrones de valencia, tenderán a ganar 2
poseyendo siempre con el H y con los metales número de oxidación –2.
Los halógenos
(grupo 17, o grupo del F) tienen 7 electrones de valencia, tenderán a ganar 1
poseyendo siempre con el H y con los metales número de oxidación –1.
Dentro de los metales
de transición debemos saber que la Ag tiene número de oxidación +1,
el Zn y Cd tienen número de oxidación +2, y el Sc, Y
y La tienen número de oxidación +3.
Los grupos 14 al 17
presentan varios números de oxidación cuando formen oxácidos, pero ya los
estudiaremos más adelante.
| |||||||||||||||||||||||||||||||||||||


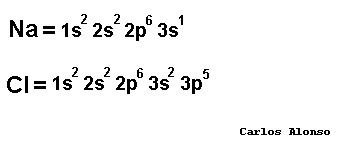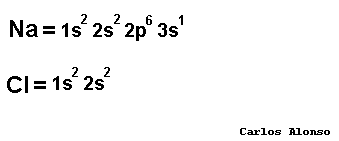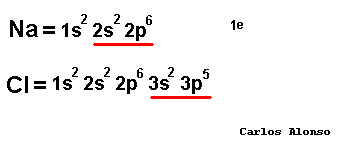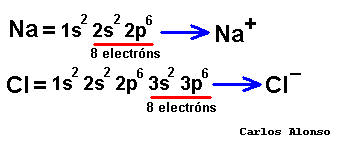

No hay comentarios:
Publicar un comentario
TUS COMENTARIOS SON MUY ÚTILES PARA MEJORAR LA CONSTRUCCIÓN DE ESTE CITIO.