DEBERES DE QUIMICA 1, 2,3 ....... 3ro A,B,C,D,E,F, BGU_BI. Pd2
DEBERES QUIMICA TERCERO BGU-BI
Profesor: Mgs. Luis Gilber Mosquera Cobos
(DATOS INFORMATIVOS)
DEBER 3
En las siguientes cadenas carbonadas
- Completar
la formula semidesarrollada : ejm.
CH3-.CH2-CH2.................
- Reconocer
los tipos de carbono ( 1rio, 2rio, 3............)
- En
una tabla ordenar la cantidad de carbonos encontrados por clase
y
- Escribir
la formula molecular.
 .
.
2.  .
.
 .
.
DEBER 2
Realizar una lectura
Construye un ensayo de máximo 300 palabras y destaca la importancia y aplicaciones. (manuscrito o impreso.) entrega hasta el 6 de octubre.
Presentalo a tu profesor para luego sustentarlo ante los compañeros
¿Qué es el carbón activado?
Últimamente se ha puesto de moda
hablar sobre el carbón activado en el campo de la medicina natural.
El carbón activado es un tipo de carbón especialmente poroso que tiene la cualidad de atrapar diferentes compuestos como metales pesados, gases, toxinas, algunas proteínas y productos de desecho. Desde 1550 a.C se ha utilizado como una sustancia capaz de purificar tanto el agua y aire como el propio cuerpo humano, gracias a que puede absorber las toxinas existentes tanto en el medio externo como en el cuerpo. Por ejemplo, es utilizado para diversos fines, entre ellos paliar una resaca, reducir el colesterol "malo", evitar intoxicaciones con sustancias venenosas y curar los problemas estomacales. Para entendernos mejor, es una especie de purificante y antídoto dentro del campo de la medicina.El carbón activado o carbón activo es carbón poroso que atrapa compuestos, principalmente orgánicos, presentes en un gas o en un líquido. Lo hace con tal efectividad, que es el purificante más utilizado por el ser humano.
Los compuestos orgánicos se derivan del metabolismo de los seres vivos, y su estructura básica consiste en cadenas de átomos de carbono e hidrógeno. Entre ellos se encuentran todos los derivados del mundo vegetal y animal, incluyendo el petróleo y los compuestos que se obtienen de él.
A la propiedad que tiene un sólido de adherir a su paredes una molécula que fluye, se le llama “adsorción”. Al sólido se le llama “adsorbente” y a la molécula, “adsorbato”.
El carbón activado es un tipo de carbón especialmente poroso que tiene la cualidad de atrapar diferentes compuestos como metales pesados, gases, toxinas, algunas proteínas y productos de desecho. Desde 1550 a.C se ha utilizado como una sustancia capaz de purificar tanto el agua y aire como el propio cuerpo humano, gracias a que puede absorber las toxinas existentes tanto en el medio externo como en el cuerpo. Por ejemplo, es utilizado para diversos fines, entre ellos paliar una resaca, reducir el colesterol "malo", evitar intoxicaciones con sustancias venenosas y curar los problemas estomacales. Para entendernos mejor, es una especie de purificante y antídoto dentro del campo de la medicina.El carbón activado o carbón activo es carbón poroso que atrapa compuestos, principalmente orgánicos, presentes en un gas o en un líquido. Lo hace con tal efectividad, que es el purificante más utilizado por el ser humano.
Los compuestos orgánicos se derivan del metabolismo de los seres vivos, y su estructura básica consiste en cadenas de átomos de carbono e hidrógeno. Entre ellos se encuentran todos los derivados del mundo vegetal y animal, incluyendo el petróleo y los compuestos que se obtienen de él.
A la propiedad que tiene un sólido de adherir a su paredes una molécula que fluye, se le llama “adsorción”. Al sólido se le llama “adsorbente” y a la molécula, “adsorbato”.
Después de la filtración -que tiene por objeto retener sólidos
presentes en un fluido-, no existe un sólo proceso de purificación con
más aplicaciones que el carbón activado. Entre ellas están:
- Potabilización de agua (el carbón retiene plaguicidas, grasas, aceites, detergentes, subproductos de la desinfección, toxinas, compuestos que producen color, compuestos originados por la descomposición de algas y vegetales o por el metabolismo de animales…)
- Deodorización y purificación de aire (por ejemplo, en respiradores de cartucho, sistemas de recirculación de aire en espacios públicos, venteos de drenajes y plantas de tratamiento de agua, casetas de aplicación de pinturas, espacios que almacenan o aplican solventes orgánicos…)
- Tratamiento de personas con intoxicación aguda (el carbón activado se considera el “antídoto mas universal”, y se aplica en salas de urgencias y hospitales)
- Refinación de azúcar (el carbón retiene las proteínas que dan color al jugo de caña; el objetivo fundamental de este proceso es evitar que el azúcar fermente y se eche a perder)
- Decoloración de aceites vegetales (como el de coco), glucosa de maíz y otros líquidos destinados a la alimentación
- Decoloración y deodorización de bebidas alcohólicas (como vinos de uva y destilados de cualquier origen)
- Recuperación de oro (el oro que no se puede separar de los minerales por los procesos de flotación, se disuelve en cianuro de sodio y se adsorbe en carbón activado)

¿Qué le da al carbón activado la propiedad de adsorber, principalmente moléculas orgánicas?
Cualquier partícula de carbón tiene la capacidad de adsorber. Es por
ello que algunas personas colocan carbón de leña en el refrigerador para
eliminar los olores. Lo mismo sucede si se coloca carbón en un
recipiente con agua: elimina color, sabor y olor. O bien, en el campo,
las personas queman tortilla y la ingieren para aliviarse de problemas
digestivos (como infecciones ligeras, indigestión o flatulencia).
Activar un carbón consiste en hacerlo poroso para ampliar su capacidad de adsorción. Un gramo de carbón de leña tiene un área superficial de alrededor de 50 m2. Con la activación, ésta llega a 600 u 800 m2. Es decir, aumenta entre 12 y 16 veces.
Los átomos de carbono que forman un sólido al que llamamos “carbón”, se ligan entre sí mediante uniones de tipo covalente. Cada átomo comparte un electrón con otros cuatro átomos de carbono (hay que recordar que en las uniones iónicas, el átomo más electronegativo le roba uno o más electrones al otro).
Los átomos que no están en la superficie, distribuyen sus cuatro uniones en todas las direcciones. Pero los átomos superficiales, aunque están ligados con otros cuatro, se ven obligados a hacerlo en menor espacio, y queda en ellos un desequilibrio de fuerzas. Ese desequilibrio es el que los lleva a atrapar una molécula del fluido que rodea al carbón.
La fuerza con la que el átomo superficial de carbono atrapa a la otra, se llama “Fuerza de London”, que es uno de los siete tipos de “fuerzas de Van der Waals”. Se considera una unión fisicoquímica, suficientemente fuerte para retener al adsorbato, pero no tan fuerte como para considerarla una unión química irreversible que forma una nueva estructura molecular. Por ello, la adsorción es reversible y el carbón activado puede reactivarse para utilizarse de nuevo.
Como dijimos, las moléculas que adsorbe el carbón tienden a ser covalentes; no iónicas, pues estas últimas tratarían de robar o de donar electrones a los átomos de carbono. Las uniones entre átomos de carbono e hidrógeno son covalentes, y es por ello que el carbón es un buen adsorbente de moléculas orgánicas.
No todas las moléculas orgánicas tiendan a ser covalentes. Suelen contener átomos de oxígeno, azufre y otros de alta electronegatividad, que dan tendencia iónica a la parte de la molécula que los contiene. Por otro lado, no todas las moléculas inorgánicas tienden a ser iónicas; también las hay de tendencia covalente. Tal es el caso del dicianuro de oro, que hace del carbón activado una parte esencial del proceso de extracción de este metal precioso.
Activar un carbón consiste en hacerlo poroso para ampliar su capacidad de adsorción. Un gramo de carbón de leña tiene un área superficial de alrededor de 50 m2. Con la activación, ésta llega a 600 u 800 m2. Es decir, aumenta entre 12 y 16 veces.
Los átomos de carbono que forman un sólido al que llamamos “carbón”, se ligan entre sí mediante uniones de tipo covalente. Cada átomo comparte un electrón con otros cuatro átomos de carbono (hay que recordar que en las uniones iónicas, el átomo más electronegativo le roba uno o más electrones al otro).
Los átomos que no están en la superficie, distribuyen sus cuatro uniones en todas las direcciones. Pero los átomos superficiales, aunque están ligados con otros cuatro, se ven obligados a hacerlo en menor espacio, y queda en ellos un desequilibrio de fuerzas. Ese desequilibrio es el que los lleva a atrapar una molécula del fluido que rodea al carbón.
La fuerza con la que el átomo superficial de carbono atrapa a la otra, se llama “Fuerza de London”, que es uno de los siete tipos de “fuerzas de Van der Waals”. Se considera una unión fisicoquímica, suficientemente fuerte para retener al adsorbato, pero no tan fuerte como para considerarla una unión química irreversible que forma una nueva estructura molecular. Por ello, la adsorción es reversible y el carbón activado puede reactivarse para utilizarse de nuevo.
Como dijimos, las moléculas que adsorbe el carbón tienden a ser covalentes; no iónicas, pues estas últimas tratarían de robar o de donar electrones a los átomos de carbono. Las uniones entre átomos de carbono e hidrógeno son covalentes, y es por ello que el carbón es un buen adsorbente de moléculas orgánicas.
No todas las moléculas orgánicas tiendan a ser covalentes. Suelen contener átomos de oxígeno, azufre y otros de alta electronegatividad, que dan tendencia iónica a la parte de la molécula que los contiene. Por otro lado, no todas las moléculas inorgánicas tienden a ser iónicas; también las hay de tendencia covalente. Tal es el caso del dicianuro de oro, que hace del carbón activado una parte esencial del proceso de extracción de este metal precioso.
¿A partir de qué materias primas puede obtenerse un carbón activado?
En teoría, podría activarse cualquier partícula de carbón. No
obstante, si el carbón está muy ordenado (como es el caso del diamante o
el grafito), es difícil eliminar algunos átomos de carbono para generar
poros.
Una manera de clasificar carbones, se basa en el grado de “coquización” u ordenamiento de sus átomos de carbono. Mientras menos ordenados, el carbón es menos duro y puede activarse con mayor facilidad.
Las materias primas más utilizadas para fabricar carbón activado son: maderas poco duras (como la de pino), carbones minerales (ligníticos, bituminosos y de antracita) y cáscaras o huesos de vegetales (concha de coco, hueso de aceituna o de durazno, cáscara de nuez).
Los carbones activados fabricados a partir de maderas poco duras, forman poros de diámetro grande, y son particularmente adecuados para decolorar líquidos.
Los que se fabrican a partir de carbones minerales, tienden a formar una amplia gama de poros; suelen ser más adecuados para aplicaciones en las que los compuestos que buscan retenerse son de distintos tamaños moleculares.
Los que parten de cáscaras o huesos duros, forman poros pequeños, y se aplican en el tratamiento de gases o en la potabilización de aguas que provienen de pozos.
Una manera de clasificar carbones, se basa en el grado de “coquización” u ordenamiento de sus átomos de carbono. Mientras menos ordenados, el carbón es menos duro y puede activarse con mayor facilidad.
Las materias primas más utilizadas para fabricar carbón activado son: maderas poco duras (como la de pino), carbones minerales (ligníticos, bituminosos y de antracita) y cáscaras o huesos de vegetales (concha de coco, hueso de aceituna o de durazno, cáscara de nuez).
Los carbones activados fabricados a partir de maderas poco duras, forman poros de diámetro grande, y son particularmente adecuados para decolorar líquidos.
Los que se fabrican a partir de carbones minerales, tienden a formar una amplia gama de poros; suelen ser más adecuados para aplicaciones en las que los compuestos que buscan retenerse son de distintos tamaños moleculares.
Los que parten de cáscaras o huesos duros, forman poros pequeños, y se aplican en el tratamiento de gases o en la potabilización de aguas que provienen de pozos.
¿Qué forma física tiene un carbón activado?
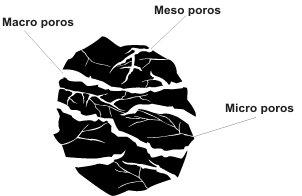
El carbón puede producirse en forma de polvo, de gránulos o de pelets cilíndricos.
El polvo sólo se aplica en la purificación de líquidos; el carbón se dosifica en un tanque con agitación y luego se separa del líquido por medio de un filtro adecuado para retener partículas pequeñas (como es el filtro prensa).
En el caso del carbón granular, se produce en diferentes rangos de partícula, que se especifican con base en la granulometría o número de malla. Una malla 4, por ejemplo, es la que tiene cuatro orificios en cada pulgada lineal. Se aplican, tanto en la purificación de líquidos como de gases.
Los pelets se aplican normalmente en el tratamiento de gases, ya que su forma cilíndrica produce una menor caída de presión.
Para el caso de que se desea un carbón granular o pelet, si la materia prima no es suficientemente dura, se puede reaglomerar con un agente ligante que le imparte dureza para evitar que se rompa al paso del fluido.
El polvo sólo se aplica en la purificación de líquidos; el carbón se dosifica en un tanque con agitación y luego se separa del líquido por medio de un filtro adecuado para retener partículas pequeñas (como es el filtro prensa).
En el caso del carbón granular, se produce en diferentes rangos de partícula, que se especifican con base en la granulometría o número de malla. Una malla 4, por ejemplo, es la que tiene cuatro orificios en cada pulgada lineal. Se aplican, tanto en la purificación de líquidos como de gases.
Los pelets se aplican normalmente en el tratamiento de gases, ya que su forma cilíndrica produce una menor caída de presión.
Para el caso de que se desea un carbón granular o pelet, si la materia prima no es suficientemente dura, se puede reaglomerar con un agente ligante que le imparte dureza para evitar que se rompa al paso del fluido.
¿Cómo se activa un carbón?
El carbón puede activarse mediante procesos térmicos o químicos. Los
procesos térmicos consisten en provocar una oxidación parcial del
carbón, para lograr que se formen los poros, pero evitando que se
gasifique y se pierda más carbón del necesario. Esto ocurre a
temperaturas que están entre los 600 y los 1100 °C, y en una atmósfera
controlada (que se logra mediante la inyección de una cantidad adecuada
de vapor de agua o de nitrógeno).
Los procesos químicos parten de la materia prima antes de carbonizarse. Los reactivos son agentes deshidratantes (como ácido fosfórico) que rompen las uniones que ligan entre sí a las cadenas de celulosa. Después de esta etapa, el material se carboniza a una temperatura relativamente baja (de unos 550 °C) y luego se lava para eliminar los restos de reactivo y de otros subproductos.
Los hornos en los que se activa un carbón térmicamente o en los que se carboniza un carbón previamente tratado con un químico, pueden ser rotatorios o verticales (de etapas).
Los procesos químicos parten de la materia prima antes de carbonizarse. Los reactivos son agentes deshidratantes (como ácido fosfórico) que rompen las uniones que ligan entre sí a las cadenas de celulosa. Después de esta etapa, el material se carboniza a una temperatura relativamente baja (de unos 550 °C) y luego se lava para eliminar los restos de reactivo y de otros subproductos.
Los hornos en los que se activa un carbón térmicamente o en los que se carboniza un carbón previamente tratado con un químico, pueden ser rotatorios o verticales (de etapas).
¿Cuál es la capacidad de adsorción del carbón activado?
La capacidad de un carbón activado para retener una sustancia
determinada no sólo está dada por su área superficial, sino por la
proporción de poros cuyo tamaño sea el adecuado, es decir, un poco
adecuado tiene un diámetro de entre una y cinco veces la molécula de que
se va a adsorber.
Si se cumple esta condición, la capacidad de un carbón activado puede ser de entre el 20% y el 50% de su propio peso.
Si se cumple esta condición, la capacidad de un carbón activado puede ser de entre el 20% y el 50% de su propio peso.
¿Cómo elimina el carbón activado el cloro libre presente en el agua?
La decloración consiste en un mecanismo complicado que puede seguir
distintos caminos de reacción en los que el CA puede intervenir como
reactivo o como catalizador.
El cloro libre puede adicionarse al agua en forma de cloro gas, solución de hipoclorito de sodio, o tabletas -gránulos- de hipoclorito de calcio.
En cualquiera de estos casos, el cloro queda disuelto en forma de ácido hipocloroso (HOCl), un ácido débil que tiende a disociarse parcialmente.
Las distribución entre ácido hipocloroso y ión hipoclorito depende del pH y de la concentración de estas especies. A ambas formas moleculares se les define como cloro libre.
Las dos son fuertes oxidantes que al ser adicionados al agua reaccionan de manera casi inmediata con impurezas orgánicas e inorgánicas, y ejercen un efecto biocida en los microorganismos.
El cloro que reacciona y el que interviene en esta etapa de desinfección, deja de ser libre y queda combinado y deja de ser libre. Una vez terminada esta etapa, es necesario eliminar el cloro libre residual, mediante carbón activado granular.
Cuando el carbón se expone al cloro libre, se llevan a cabo reacciones en las que el HOCl o el OCl- se reducen a ión cloruro. Dicha reducción es el resultado de distintos caminos de reacción posibles.
En dos de los más comunes, el CAG actúa de acuerdo con las siguientes reacciones:
En donde C* representa al carbón activado. C*O y C*O2 son óxidos superficiales, que poco a poco van ocupando espacios que, al quedar bloqueados, ya no participan en la reacción. Algunos de estos óxidos se liberan hacia la solución como CO y CO2. Esto vuelve a dejar espacios disponibles que por lo tanto aumentan la capacidad del CAG para esta reacción.
En cuanto al , también se acumula en la superficie del carbón durante los primeros momentos de operación. Al seguir llegando HOCl o a la superficie del carbón, la reacción se hace un poco más lenta, y entonces se empieza a liberar el . Esta disminución de velocidad se debe al envenenamiento del carbón con los óxidos superficiales. Dicho envenenamiento continúa de manera gradual, mientras disminuye la capacidad, tanto de adsorción como de decloración del CA.
En las reacciones anteriores puede intervenir en lugar de HOCl, con la diferencia que no se produce H+. Puede observarse que el CA reacciona y por lo tanto desaparece. Si no hubiera acumulación de óxidos superficiales, la reacción continuaría hasta la desaparición completa del carbón.
El cloro libre puede adicionarse al agua en forma de cloro gas, solución de hipoclorito de sodio, o tabletas -gránulos- de hipoclorito de calcio.
En cualquiera de estos casos, el cloro queda disuelto en forma de ácido hipocloroso (HOCl), un ácido débil que tiende a disociarse parcialmente.
Las distribución entre ácido hipocloroso y ión hipoclorito depende del pH y de la concentración de estas especies. A ambas formas moleculares se les define como cloro libre.
Las dos son fuertes oxidantes que al ser adicionados al agua reaccionan de manera casi inmediata con impurezas orgánicas e inorgánicas, y ejercen un efecto biocida en los microorganismos.
El cloro que reacciona y el que interviene en esta etapa de desinfección, deja de ser libre y queda combinado y deja de ser libre. Una vez terminada esta etapa, es necesario eliminar el cloro libre residual, mediante carbón activado granular.
Cuando el carbón se expone al cloro libre, se llevan a cabo reacciones en las que el HOCl o el OCl- se reducen a ión cloruro. Dicha reducción es el resultado de distintos caminos de reacción posibles.
En dos de los más comunes, el CAG actúa de acuerdo con las siguientes reacciones:
En donde C* representa al carbón activado. C*O y C*O2 son óxidos superficiales, que poco a poco van ocupando espacios que, al quedar bloqueados, ya no participan en la reacción. Algunos de estos óxidos se liberan hacia la solución como CO y CO2. Esto vuelve a dejar espacios disponibles que por lo tanto aumentan la capacidad del CAG para esta reacción.
En cuanto al , también se acumula en la superficie del carbón durante los primeros momentos de operación. Al seguir llegando HOCl o a la superficie del carbón, la reacción se hace un poco más lenta, y entonces se empieza a liberar el . Esta disminución de velocidad se debe al envenenamiento del carbón con los óxidos superficiales. Dicho envenenamiento continúa de manera gradual, mientras disminuye la capacidad, tanto de adsorción como de decloración del CA.
En las reacciones anteriores puede intervenir en lugar de HOCl, con la diferencia que no se produce H+. Puede observarse que el CA reacciona y por lo tanto desaparece. Si no hubiera acumulación de óxidos superficiales, la reacción continuaría hasta la desaparición completa del carbón.
¿Qué tipo de carbón es el más adecuado para decolorar?
Los colores que se manifiestan en líquidos suelen ser moléculas de
tamaño relativamente grande. Por lo tanto, se adsorben en poros grandes,
lo que hace que los carbones más adecuados para retenerlos sean los de
mayor macroporosidad.
Los carbones de madera, particularmente los de maderas no muy duras (como pino) que se activan químicamente, son los más macroporosos y, por lo tanto, son los más adecuados para decolorar.
El problema de estos carbones es que son poco duros y poco resistentes a la abrasión, lo que obliga a aplicarlos en forma de polvo. Cuando se requiere que el carbón decolorante sea granular, la mejor alternativa suele ser un carbón de lignita. Es el carbón mineral de mayor macroporosidad.
Los carbones de madera, particularmente los de maderas no muy duras (como pino) que se activan químicamente, son los más macroporosos y, por lo tanto, son los más adecuados para decolorar.
El problema de estos carbones es que son poco duros y poco resistentes a la abrasión, lo que obliga a aplicarlos en forma de polvo. Cuando se requiere que el carbón decolorante sea granular, la mejor alternativa suele ser un carbón de lignita. Es el carbón mineral de mayor macroporosidad.
¿Qué tipo de carbón activado es el más adecuado para potabilizar agua?
Los contaminantes típicamente presentes en aguas de pozo suelen ser
de bajo peso molecular y, para estos casos, el carbón más adecuado es
uno de alta microporosidad.
Los carbones que mejor cumplen con esta condición son, en primer lugar, los de concha de coco y, posteriormente, los minerales bituminosos.
Los carbones que mejor cumplen con esta condición son, en primer lugar, los de concha de coco y, posteriormente, los minerales bituminosos.
¿Por qué varía el pH del agua cuando se instala un carbón virgen?
Cuando un carbón se activa químicamente, es impráctico e innecesario
que el fabricante elimine del producto final todo el químico utilizado.
Por lo tanto, si el químico fue un ácido, disminuirá el pH de los
primeros litros de agua que entran en contacto con el carbón. Ocurrirá
lo contrario si el químico utilizado fue un álcali.
En el caso de un carbón activado térmicamente (sin la presencia de otros químicos que no sean vapor de agua y gases de combustión), aumenta el pH de los primeros litros de agua que se trata con el mismo.
Esto se debe a que todos los vegetales tienen cantidades importantes de sodio, potasio, calcio y otros catiónes que, en el proceso de carbonización, permanecen en el carbón en forma de óxidos. Estos óxidos se convierten en hidróxidos al entrar en contacto con el agua, se disuelven en la misma y aumentan su pH.
Cuando no varía el pH de los primeros litros de agua que entran en contacto con un carbón, puede tratarse de un carbón de pH ajustado o de un carbón ultrapuro (libre de solubles).
En el caso de un carbón activado térmicamente (sin la presencia de otros químicos que no sean vapor de agua y gases de combustión), aumenta el pH de los primeros litros de agua que se trata con el mismo.
Esto se debe a que todos los vegetales tienen cantidades importantes de sodio, potasio, calcio y otros catiónes que, en el proceso de carbonización, permanecen en el carbón en forma de óxidos. Estos óxidos se convierten en hidróxidos al entrar en contacto con el agua, se disuelven en la misma y aumentan su pH.
Cuando no varía el pH de los primeros litros de agua que entran en contacto con un carbón, puede tratarse de un carbón de pH ajustado o de un carbón ultrapuro (libre de solubles).
¿Qué tipo de carbón activado es el más adecuado para purificar aire y gases?
Todos los contaminantes en estado gaseoso tienen diámetros
moleculares menores a 2 nm. Esto significa que se adsorben
preferentemente en microporos. Los carbones de concha de coco son los de
mayor microporosidad y, por lo tanto, son los más usados en la
purificación de aire y gases.
Existen los carbones activados de estructura modificada, carbón activado especial, que se utilizan cuando un carbón activado estándar no puede retener otros compuestos no orgánicos.
Existen los carbones activados de estructura modificada, carbón activado especial, que se utilizan cuando un carbón activado estándar no puede retener otros compuestos no orgánicos.
En Carbotecnia somos fabricantes y especialistas de carbón activado.
Puede consultar los diferentes tipos de carbón activado que manejamos aquí.
Algunos productos que te pueden interesar
¿QUÉ ES LA EVALUACION DIAGNÓSTICA ?
http://quimica1cecyteglsjb.blogspot.com/p/evaluacion-diagnostica.html
T:2:
http://www.creartest.com/hacertests-95456-Evaluacion_diagnostica_sobre_Quimica_.php
DEBER 1 contestado parcialmente para corrección.
Imprime y responde.
UNIDAD EDUCATIVA DEL MILENIO BERNARDO VALDIVIESO
ALUMNA/O: .................................................................
CURSO:..............PARALELO: ...................................
FECHA: ........................................................................
DEBER 1.
1. La química es LAS RESPUESTAS CORRECTAS ESTAN DE COLOR INTENSO
. Una rama de la biología y de la física
. Un procedimiento de calculo para explicar la naturaleza
. Una ciencia que estudia la transformación de la materia
. Un método de análisis para indicar los fenómenos físicos
2. Herramienta de la química que organiza e informa sobre las sustancias de componen nuestro entorno
. Reacciones químicas
. Tabla periódica
. Fórmulas químicas
. Experimentos químicos
3. ¿Cuál de las siguientes sustancias es metal?
Hierro, Holmio, nitrógeno
.Cromo, helio, bario
. Carbono,teluro, cobre
.Plomo, mercurio, plata
4. ¿Cuáles de las siguientes sustancias son no metal?
. Litio, azufre, selenio
. Carbono, fluor, calcio
. Nitrógeno,azufre,bromo
.Yodo, alumicio, oxigeno
5. A las columnas de la Tabla Periódica se les llama
. Periodos
. Grupos
. Niveles de energía
. Orbitales
6. Los elementos químicos se dividen en cuatro grandes prupos
. Metales, átomos, moléculas y no metales
. Metales, no metales, metaloides y gases nobles
. Gases, metales, compuestos y no metales
. Grupos, periodos,soluciones y átomos
7. Los átomos están formados por
. compuestos, elementos y mezclas
. energía, elementos y protones
. protones, electrones y neutrones
. radiaciones, electrones y compuestos
. energía, elementos y protones
. protones, electrones y neutrones
. radiaciones, electrones y compuestos
8. En la fórmula Ca3 (PO4)2 (fosfato de calcio) es cierto que
. Está formada en total por 9 átomos
. contiene 5 átomos de calcio
. la molécula tiene 4 oxígenos
. son 2 los átomos de fósforo ..
9. Un cambio químico ocurre cuando la materia se transforma dando origen a otro tipo de materia diferente a la original.
A continuación se presentan una serie de cambios, indique cual es químico
. Fundir una vela de cera
. Hervir agua
. quemar un papel
. derretir chocolate
. Hervir agua
. quemar un papel
. derretir chocolate
10.La molécula del carbonato de sodio tiene una fórmula Na2CO3, esto significa que por cada molécula hay 1 atómo de carbono, 2 átomos de sodio y 3 átomos de oxígeno. Si tenemos 18 átomos de sodio y 24 átomos de oxígeno, existen.......
. 9 moléculas de carbonato de sodio y sobran 2 átomos de oxígeno
. 8 moléculas de carbonato de sodio y sobran 9 átomos de sodio
. 9 moléculas de carbonato de sodio y sobran 8 átomos de oxígeno
. 8 moleculas de carbonato de sodio y sobran 2 átomos de sodio
11.Un cm3 es igual a un mililitro. Si tenemos un litro de agua quiere decir que hay
. 1000 cm3
. 0.001 mililitros
. 100 cm3
. 0.01 mililitros
12.
Numerosos blanqueadores para lavandería contienen hipoclorito de sodio o
decalcio como ingredienteactivo. El clorox por ejemplo, ontiene aproximadamente
52 g de NaClO por litro de solución. ¿Cuál es la molaridad de esta
solución? Rta. 0.70 M
M:....?
52g. NaClO
SOLUCION:
1. Calcular el peso de una mol de NaClO: 74,5 g/mol
2. Calcular la Molaridad: Si 74,5 g de NaClO...... forman una solución 1M
52 g. de NaClO....____________________ X
52g. de NaClO x 1M
X= --------------------------------------------------- = 0,697 = 0,70 M
74,5g de NaClO
SOLUCION:
1. Calcular el peso de una mol de NaClO: 74,5 g/mol
2. Calcular la Molaridad: Si 74,5 g de NaClO...... forman una solución 1M
52 g. de NaClO....____________________ X
52
X= --------------------------------------------------- = 0,697 = 0,70 M
74,5
13.
Para calcular la N, se observa que el NaCNes una sal que contiene un solo átomo
de sodio , cuya valencia del sodio es uno, por lo que en una mol de esta
sal hay un equivalente de NaCN. La respuesta puede obtenerse fácilmente a
partir de la molaridad:
Rta.
0.204 equivalentes; y 0.816 N
SOLUCIÓN.
Calcular utilizando los datos de la respuesta para encontrar gramos de muestra, luego a N y Eq.
SOLUCIÓN.
Calcular utilizando los datos de la respuesta para encontrar gramos de muestra, luego a N y Eq.
14.
Preparar una solución acuosa 1.5 molal (1.5 m) de KOH.
Rta.
84,00 g ( significa que al Pesar 84 g de KOH y disolverlo en 1 litro de
agua. La solución resultante contiene 1.5 moles de KOH/ 1 kg de disolvente)
15. ¿Qué
volumen de una solución de Ca(OH)2 0.125 M se requiere para
neutralizar todo el ácido láctico contenido en 3.50 litros de una solución
0.650 M?
Datos:
V1= ¿?
M1= 0.125
M
V2=3.50
litros
M2=0.650
M
Ecuacion:
V1M1= V2M2 ......DESPEJADO ......V1 = V2 X M2 / M1
16.
Determine
la concentración en equivalentes por litro (normalidad) de una solución que fue
preparada disolviendo 15 gramos de H3PO4 en suficiente
agua hasta completar 650 ml de solución.
Rta:
N= 0,7 eq/L
17.
Determine
los gramos de soluto que están contenidos en 3000 ml de solución de Ni(ClO2)2
con una concentración de 0,5 eq/L. Rta. 145.5 g
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
REVISAR
https://prezi.com/b4tnks2dbr7p/unidad-didactica-quimica-organica-enlaza-mi-carbono/
Realiza el test:
http://www.100ciaquimica.net/temas/tema11/index.htm
Ingresa al lin y realiza el tema 11, son 40 preguntas
1. Ingresa al link, se abre la pagina y en el extremo izquierdo inferior esta TEST INTERCTIVO pincha e inicia tu autoevaluacion hasta finalizar.
2. Luego de concluida su autoevaluación, comparta los resultados ingresando mi correo: luisgilbermosquera@gmail.com para registrar su trabajo (si no asoma la opcion, enviar capturas de pantalla)
PARTICULAS SUBATOMICAS
JUEGO INTERACTIVO:
http://recursostic.educacion.es/ciencias/ulloa/web/ulloa2/3eso/secuencia5/oa6/pag1/index.html
DEBER 2 PARA ESTUDIANTES REZAGADOS:
(quienes no presentaron el tema 1)
UNIDAD EDUCATIVA DEL MILENIO BERNARDO VALDIVIESO
ALUMNA/O: .................................................................
CURSO:..............PARALELO: ...................................
FECHA: ........................................................................
 1. Clasifica los
siguientes sistemas materiales en mezclas
homogéneas y heterogéneas:
1. Clasifica los
siguientes sistemas materiales en mezclas
homogéneas y heterogéneas:
a) azúcar y cacao en polvo
|
c) agua con arcilla
|
e) agua con aceite
|
b) agua con sal y azúcar
|
d) hierro y harina
|
f) agua
con alcohol
|
2. Responde
verdadero o falso, y justifica tu respuesta, a los siguientes enunciados:
a) Necesitas conocer
las proporciones adecuadas para
preparar una mezcla
heterogénea de sal y
limaduras de hierro.
b) Las propiedades del hierro y de la sal se han modificado al formar la mezcla.
c) Para preparar esta mezcla es necesario agregar la misma cantidad de sal y de hierro.
d) El
hierro conserva sus propiedades magnéticas
aun estando mezclado con la
sal.
3. Completa las siguientes
frases:
a) si se quiere separar la arena de
limaduras de hierro hay que utilizar …………………………………………
b) el proceso para separar mezclas
heterogéneas de sólidos y líquidos se llama ………………………………………………..
c) la
………………………… es una técnica
de separación de líquidos miscibles con distintas
volatilidades y puntos de ebullición.
d) La técnica de separación de los
componentes de una mezcla
basada en la
velocidad de desplazamiento de una
sustancia a
través de un soporte poroso se llama ………………………………………………..
e)
En el bronce (aleación
de cobre y estaño con un 20% de
estaño), el soluto es el
……………….. y el disolvente, el ………………
f) Algunas
disoluciones, como las
de sal en agua, se pueden separar por ……………………………………………………..
4. Una mezcla sólida formada por las sustancias A, B, C
y D contiene las siguientes cantidades: 15 g de A, 40 g de B, 150 g de C
y 350 g de D. Halla el porcentaje en masa de cada sustancia. sol: A=2,9%; B=7,21%; C=27,03%;D=63,06%
5. Una disolución
contiene 15 g de cloruro de sodio y ocupa un volumen
de 100 ml. Calcula: a) la concentración
de la disolución expresada en g/L, b) la cantidad
de soluto que es necesario disolver
en agua para preparar
3,5 L de disolución de la concentración dada.
sol: a) 150 g/L; b)
525 g
6. Una disolución
contiene 5 g de sulfato de cobre(II) en 100 cm3 de disolución y otra
tiene 3,5 g en 60 cm3 de disolución. ¿Cuál de las dos disoluciones es la más
concentrada?
sol: CA=50 g/L; CB=58,3 g/L; CB>CA
7. La concentración de una disolución de hidróxido de sodio en agua es
del 2% en masa, ¿qué cantidad de hidróxido de
sodio hay en 0,25 Kg de
disolución?
sol: 5 g
9. Si en 200 mL de
cierta disolución acuosa hay 12,0
g de azúcar y la densidad de dicha disolución es de 1,022 g/cm3, ¿cuál
es la concentración de
ésta en tanto por
ciento en masa y en g/L?
sol: 5,87%; 60 g/L
10. El apiretal,
es un conocido medicamento
infantil, cuyo principio
activo es paracetamol y
que se vende en farmacias, en frascos
de 30 mL, con un
gotero‐dosificador de 2 mL. Halla: a) ¿Cuántos gramos de paracetamol hay en el frasco comprado
en la farmacia? b) A un niño pequeño hay que
administrarle 0,6 g de paracetamol al día. ¿Cuántas dosis aproximadas de gotero habrá que usar? c) ¿cuál es la concentración de paracetamol en g/L? d) Si sabemos que
la densidad del apiretal es de
1,14 g/mL
¿cuál es la concentración
de paracetamol en % en masa? sol: a) 3 g; b) 30 dosis;
c) 100 g/L; d) 8,77%
11. Un suero tiene una concentración de azúcar de 8 g/L y densidad = 1,08 g/mL. Calcula: a) qué masa
de disolución y de azúcar habrá en una botella de 250 mL, b)
A un enfermo es necesario suministrarle una dosis
de 17 g de azúcar al
día, ¿cuántos frascos de suero necesitaremos? c) ¿cuál es
la concentración de glucosa en % en masa?
sol: a) 270 g; b) 8,5 frascos; c) 0,74%
12. En un
laboratorio se analiza el contenido en
bicarbonato de tres clases de
agua mineral: marca A: (278,2 mg/L) marca B: (90,1 mg/L) y marca C: (275,5 mg/L); si te bebes
un
vaso de 250 mL de cada una de ellas
¿cuántos gramos
de bicarbonato habrás ingerido?
sol: 160,96 mg
 13. Se prepara una disolución de éter y cloroformo agregando
10 mL de éter a 90 mL de
cloroformo. ¿cuál es el % en volumen de esta disolución?
sol: 10%
13. Se prepara una disolución de éter y cloroformo agregando
10 mL de éter a 90 mL de
cloroformo. ¿cuál es el % en volumen de esta disolución?
sol: 10%
14. Una
lejía posee una concentración de 20
g/L en hipoclorito de
sodio y se vende en recipientes de 5 L. Para
efectuar una limpieza, llenamos un tapón (18 mL) y lo echamos en un cubo con 38 L de agua. Despreciando la variación de volumen, halla la concentración en g/L de la lejía en el cubo de la limpieza. sol: 9,47.10-3 g/L
15. Mezclamos 20 mL
de alcohol (d= 0,81
g/mL) con 270 mL de
agua. Determina:
a) la concentración de la
disolución en g/L. c) la
concentración de la disolución en % en masa y en % en volumen.
b) Explica qué le sucedería a la concentración de la disolución si
añadiésemos más agua: aumentaría, disminuiría o quedaría igual.
sol: a) 60
g/L; b) 5,66% masa y 6,9% volumen; c) disminuye
16. Una
disolución de sulfato de sodio en agua tiene
una
concentración del 14%
a) ¿qué información proporciona este
dato?
b)
¿qué
cantidad de sulfato de sodio
habrá disuelto en un recipiente que contenga 120
g de
esta disolución? sol: 16,8 g
17. Un litro de
leche contiene 44 g de lactosa. Si la densidad de la leche es de 1,03 g/cm3. Halla el
tanto por ciento en masa
de lactosa y su concentración en g/100 mL. sol: a) 4,27%;
b) 44 g/L
18. En un
recipiente echamos 20 terrones
de azúcar y completamos
con 2,5 L de agua. ¿cuál
es la concentración del azúcar
en la disolución, expresada en g/L, sabiendo
que 1 terrón de azúcar pesa 3
g?
sol: 24 g/L
19. En un
recipiente con agua, echamos 3 g de sal hasta obtener un
volumen de disolución de
4 L
¿qué cantidad de sal
contiene otro recipiente de 0,5 L de
disolución, de igual concentración que la
anterior?
sol: 0,375 g
20. La
composición de una crema
hidratante es:
Si ésta se presenta en envases
de 50 mL, calcula el volumen que contiene de cada
21. Se
añaden 2,5 g de azúcar a 50 mL de
agua, se agita para que se disuelva el azúcar y se comprueba
que el volumen de la disolución es de 52 mL. Halla la
densidad de la disolución en g/L y la concentración de azúcar en la misma,
expresada en g/L.
22. En una muestra
de 20 mL de sangre se han
encontrado 1,50 g de glucosa ¿cuál es
la concentración en g/L de glucosa en sangre?
sol: 75 g/L
23. Un conocido medicamento
para los síntomas del resfriado se vende en sobres de 10 g, en los que el 5%
es del principio activo
(ácido acetilsalicílico). Un
enfermo necesita tomar 3 sobres diarios,
previamente disueltos en agua. Halla:
a) ¿Qué cantidad
del principio activo
ingiere al día?
b) Si al disolver un sobre consigue una disolución de 20 mL, ¿qué
concentración
del principio activo hay

en ella?
sol: a) 1,5 g; b) 75 g/L
24. El
médico te receta un medicamento que tiene una concentración de ácido acetilsalicílico del 32%.
¿Qué cantidad de dicho
ácido hay en un sobre de 500 mg?
sol: 160 mg
25. La concentración de una disolución
acuosa de nitrato de potasio
es de 15 g/L, ¿qué cantidad
de nitrato de potasio hay en
25 cm3 de
disolución?
sol: 0,375 g
26. Un detergente amoniacal
tiene una concentración del 12% en amoniaco y una densidad de 1,24
g/mL.
¿cuál será la concentración del
detergente en g/L?
sol: 148,7 g/L
27. La
tasa de alcohol en sangre permitida para conductores es de 0,5 g/L.
Una persona se toma una lata de cerveza (33 cL) que posee un 4% en volumen de alcohol. Admitiendo que el volumen total de sangre
de esa persona es de unos 6 L, ¿daría positivo si lo paran en un control?
(densidad del alcohol =
0,79 g/mL)
sol: 1,74 g/L; Si
|
 28. La
etiqueta de una botella de 1,5 L de agua mineral indica que posee una concentración
de 74 mg/L de bicarbonato,
42
mg/L de sodio y 110 mg/L de
cloruros. Determinar: a) ¿qué
volumen de esa botella deberíamos beber para
que contuviera 25 mg de sodio?
b) ¿qué cantidad total de
bicarbonato habrá en un paquete de 6 botellas de 1,5 L? c) ¿qué
cantidad de cloruros
ingerimos en un vaso de 120 mL de
agua mineral? sol: a) 0,59 L; b)
666 mg; c) 13,2
28. La
etiqueta de una botella de 1,5 L de agua mineral indica que posee una concentración
de 74 mg/L de bicarbonato,
42
mg/L de sodio y 110 mg/L de
cloruros. Determinar: a) ¿qué
volumen de esa botella deberíamos beber para
que contuviera 25 mg de sodio?
b) ¿qué cantidad total de
bicarbonato habrá en un paquete de 6 botellas de 1,5 L? c) ¿qué
cantidad de cloruros
ingerimos en un vaso de 120 mL de
agua mineral? sol: a) 0,59 L; b)
666 mg; c) 13,2
29. Halla la pureza en nitrato de amonio de un saco de 5 Kg que contiene dicha sustancia e impurezas, si la cantidad de nitrato de amonio que hay es de 4,25 Kg. sol: 85%

No hay comentarios:
Publicar un comentario
TUS COMENTARIOS SON MUY ÚTILES PARA MEJORAR LA CONSTRUCCIÓN DE ESTE CITIO.