Estudiantes que np asistieron semana del 5 de enero, deben pasar resumen a cuaderno de materia
Configuración electrónica o configuración periódica
Configuración electrónica (o periódica)
Es la descripción de la ubicación de los electrones
en los distinto
s niveles (con subniveles y orbitales) de un
determinado átomo.
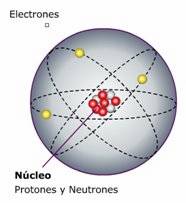 |
| Modelo atómico general. |
Configurar significa "ordenar" o "acomodar", y electrónico
deriva de "electrón"; así, configuración electrónica
es la manera
ordenada de repartir los electrones en los niveles y subniveles de
energía.
Científicamente, diremos que es la representación del modelo atómico de Schrödinger o modelo de la
mecánica cuántica. En esta representación se indican los niveles, subniveles y los orbitales que ocupan los electrones.
Los Números Cuánticos
En el contexto de la mecánica cuántica, en la descripción de un átomo se sustituye el concepto de órbita por el de
orbital atómico.
Un orbital atómico es la región del espacio alrededor del núcleo en el
que la probabilidad de encontrar un electrón es máxima.
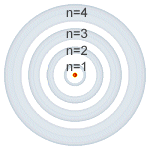 |
| Número cuántico principal (n). |
La solución matemática de la ecuación de Schrödinger precisa
de tres números cuánticos. Cada trío de valores de estos números
describe un orbital.
Número cuántico principal (n): puede tomar valores enteros (1, 2, 3, 4, 5, 6, 7) y coincide con el mismo número cuántico introducido por
Bohr.
Está relacionado con la distancia promedio del electrón al núcleo en
un determinado orbital y, por tanto, con el tamaño de este e indica el
nivel de energía.
Número cuántico secundario (l): Los niveles de energía, identificados con el
número cuántico principal (n), poseen subniveles, los cuales se asocian, además, a la
forma del orbital, y son identificados por el número cuántico secundario (l). Entonces, los valores del número cuántico secundario
dependen del número cuántico principal "n".
Así, la cantidad de subniveles de energía que posea cada nivel principal está dada por la fórmula
n – 1 (el valor del número cuántico principal menos uno).
Este número cuántico secundario (l) nos indica en que subnivel se
encuentra el electrón, y toma valores desde 0 hasta (n - 1), recordando
que n es el valor del número cuántico principal. Así, para cada nivel
n, el número cuántico secundario (l) será:
l = 0, 1, 2, 3,…, n-1.
Ejemplo:
Si n = 1 (n – 1 = 0), entonces l = 0 (en el nivel de energía
1 no hay subniveles de energía, y para efectos de comprensión se
considera este nivel 1 como subnivel 0)
Si n = 2 (n -1 = 1), entonces l = 0, 1. El nivel de energía 2 posee dos subniveles, identificados como 0 y 1
Si n = 3 (n – 1 = 2), entonces l = 0, 1, 2. El nivel de energía 3 posee tres subniveles, identificados como 0, 1 y 2
Si n = 4 (n – 1 = 3), entonces l = 0, 1, 2, 3. El nivel de
energía 4 posee cuatro subnoiveles, identificados como 0, 1, 2 y 3
Si n = 5 (n – 1 = 4), entonces l = 0, 1, 2, 3, 4. El nivel
de energía 5 posee cinco subnoveles, identificados como 0, 1, 2, 3 y 4
También para efectos de comprensión, la comunidad científica ha
aceptado que los números que representan los subniveles (0, 1, 2, y 3)
sean reemplazados por las letras s, p, d y f, respectivamente, para
representar los distintos tipos de orbitales.
Estas letras se optiene de la inicial de las palabras
sharp (s), principal (p), difuso (d) y fundamental (f).
Cada subnivel, a su vez, posee distinta cantidad de orbitales, lo cual veremos más adelante.
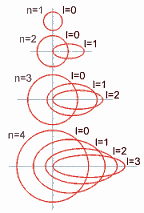
Ahora, con respecto a la forma del orbital de estos subniveles, el número cuántico secundario (o azimutal) determina la
excentricidad de la órbita: cuanto mayor sea este número, más excéntrica será la órbita; es decir, será más aplanada la elipse que recorre el electrón.
Así, en el nivel 1 (o capa K) el valor del nivel (identificado como subnivel 0) es cero (no hay excentricidad) y su
órbita es circular.
Cada vez que aumenta el valor del número cuántico secundario (o
azimutal) aumenta la excentricidad de la órbita, como se demuestra en
el siguiente gráfico:
Número cuántico magnético (ml): puede tener todos los valores
desde – l hasta + l pasando por cero. Describe la orientación espacial
del orbital e indica el número de orbitales presentes en un subnivel
determinado.
Para explicar determinadas características de los espectros de emisión
se consideró que los electrones podían girar en torno a un eje propio,
bien en el sentido de las agujas del reloj o en el sentido contrario.
Para caracterizar esta doble posibilidad se introdujo
el número cuántico de espín (ms) que toma los valores de + ½ o – ½..
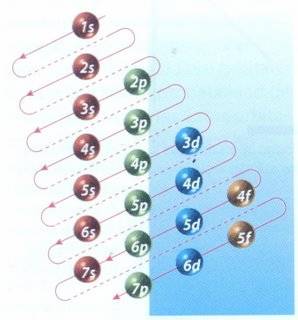 |
| Cuadro de las diagonales, mecanismo para distribuir electrones en sus diferentes niveles de energía. |
Para entender el concepto de configuración electrónica es necesario asumir o aplicar dos principios importantes:
•
Principio de Incertidumbre de Heisenberg: “Es imposible determinar simultáneamente la posición exacta y el momento exacto del electrón”
.
•
Principio de Exclusión de Pauli: “Dos electrones
del mismo átomo no pueden tener los mismos números cuánticos idénticos
y por lo tanto un orbital no puede tener más de dos electrones”.
Tipos de configuración electrónica
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar
Se representa la configuración electrónica que se obtiene usando el
cuadro de las diagonales (una de sus formas gráficas se muestra en la imagen de la derecha).
Es importante recordar que los orbitales se van llenando en
el orden en que aparecen, siguiendo esas diagonales, empezando siempre
por el 1s.
Aplicando el mencionado cuadro de las diagonales la
configuración electrónica estándar, para cualquier átomo, es la
siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Más adelante explicaremos cómo se llega este enjambre
de números y letras que perturba inicialmente, pero que es de una
simpleza sorprendente.
Configuración condensada
Los niveles que aparecen llenos en la configuración estándar
se pueden representar con un gas noble (elemento del grupo VIII A,
Tabla Periódica de los elementos), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel.
Los gases nobles son He, Ne, Ar, Kr, Xe y Rn.
Configuración desarrollada
Consiste en representar todos los electrones de un átomo
empleando flechas para simbolizar el spin de cada uno. El llenado se
realiza respetando el principio de exclusión de Pauli y la Regla de
máxima multiplicidad de Hund.
 |
| Figura de un átomo sencillo ilustrando lo indefinido de sus órbitas. |
Configuración semidesarrollada
Esta representación es una combinación entre la configuración
condensada y la configuración desarrollada. En ella sólo se representan
los electrones del último nivel de energía.
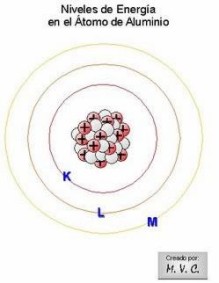
Niveles de energía o capas
Si repasamos o recordamos los diferentes
modelos atómicos
veremos que en esencia un átomo es parecido a un sistema planetario.
El núcleo sería la estrella y los electrones serían los planetas que la
circundan, girando eso sí (los electrones) en órbitas absolutamente no
definidas, tanto que no se puede determinar ni el tiempo ni el lugar
para ubicar un electrón (
Principio de Incertidumbre de Heisenberg).
Los electrones tienen, al girar, distintos niveles de energía
según la órbita (en el átomo se llama capa o nivel) que ocupen, más
cercana o más lejana del núcleo. Entre más alejada del núcleo, mayor
nivel de energía en la órbita, por la tendencia a intercambiar o ceder
electrones desde las capas más alejadas.
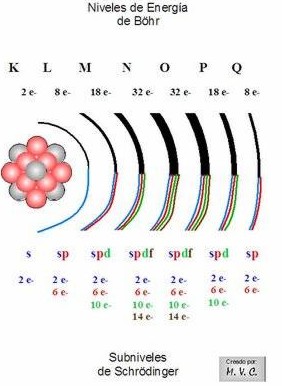
Entendido el tema de las capas, y sabiendo que cada una de ellas representa un nivel de energía en el átomo, diremos que:
1. Existen 7 niveles de energía o capas donde pueden
situarse los electrones para girar alrededor del núcleo, numerados del
1, el más interno o más cercano al núcleo (el que tiene menor nivel de
energía), al 7, el más externo o más alejado del núcleo (el que tiene
mayor nivel de energía).
Estos niveles de energía corresponden al número cuántico
principal (n) y además de numerarlos de 1 a 7, también se usan letras
para denominarlos, partiendo con la K. Así: K =1, L = 2, M = 3, N =
4, O = 5, P = 6, Q = 7.
2. A su vez, cada nivel de energía o capa tiene sus electrones repartidos en distintos
subniveles, que pueden ser de cuatro tipos:
s, p, d, f.
Para determinar la configuración electrónica de un elemento sólo
hay que saber cuantos electrones debemos acomodar y distribuir en
los subniveles empezando con los de menor energía e ir llenando hasta
que todos los electrones estén ubicados donde les corresponde.
Recordemos que partiendo desde el
subnivel s, hacia p, d o
f se aumenta el nivel de energía.
3. En cada subnivel hay un número determinado de
orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo
s, 3 orbitales
p, 5 orbitales
d y 7 del tipo
f.
De esta forma el número máximo de electrones que admite cada subnivel
es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x
5); 14 en el f (2 x 7)..
La distribución de niveles, subniveles, orbitales y número de
electrones posibles en ellos se resume, para las 4 primera capas, en la
siguiente tabla:
| Niveles de energía o capa (n) |
1
|
2 (L)
|
3 (M)
|
4 (N)
|
| Tipo de subniveles |
s
|
s p
|
s p d
|
s p d f
|
| Número de orbitales en cada subnivel |
1
|
1 3
|
1 3 5
|
1 3 5 7
|
| Denominación de los orbitales |
1s
|
2s 2p
|
3s 3p 3d
|
4s 4p 4d 4f
|
| Número máximo de electrones en los orbitales |
2
|
2 - 6
|
2 - 6 - 10
|
2 - 6 - 10 - 14
|
| Número máximo de electrones por nivel de energía o capa |
2
|
8
|
18
|
32
|
Insistiendo en el concepto inicial, repetimos que la
configuración electrónica de un átomo es la distribución de sus electrones en los distintos niveles, subniveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles
por orden de energía creciente (partiendo desde el más cercano al núcleo) hasta completarlos.
Recordemos que alrededor del núcleo puede haber un máximo de
siete capas atómicas o niveles de energía donde giran los electrones, y
cada capa tiene un número limitado de ellos.
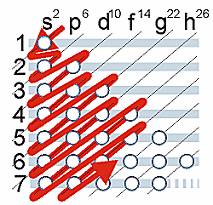
La forma en que se completan los niveles, subniveles y
orbitales está dada por la secuencia que se grafica en el esquema
conocido como
regla de las diagonales:
Es importante saber cuantos electrones existen en el nivel más
externo de un átomo pues son los que intervienen en los enlaces con
otros átomos para formar compuestos.
Regla de las diagonales
Sirve para determinar el mapa de configuración electrónica (o periódica) de un elemento.
En otras palabras, la secuencia de ocupación de los orbitales
atómicos la podemos graficar usando la regla de la diagonal, para ello
debemos seguir la flecha roja del esquema de la derecha, comenzando en
1s; siguiendo la flecha podremos ir completando los orbitales con los electrones en forma correcta.
En una configuración estándar, y de acuerdo a la secuencia
seguida en el grafico de las diagonales, el orden de construcción para
la configuración electrónica (para cualquier elemento) es el siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Los valores que se encuentran como superíndices indican la
cantidad máxima de electrones que puede haber en cada subnivel (colocando sólo dos en cada orbital de los subniveles).
Ver: PSU: Química,
Pregunta 03_2005
Pregunta 07_2006
 |
| El sodio en la tabla. |
En la tabla periódica, entre los datos que encontramos de cada uno de los elementos se hallan el
Número atómico y la
Estructura electrónica o
Distribución de electrones en niveles.
El Número atómico nos indica la cantidad de electrones y de protones que tiene un elemento.
La Estructura electrónica o Distribución de
electrones en niveles indica cómo se distribuyen los electrones en los
distintos niveles de energía de un átomo (lo que vimos más arriba con la
regla de las diagonales).
Pero, si no tengo la tabla periódica para saber
cuantos electrones tengo en cada nivel, ¿cómo puedo hacer para
averiguarlo?
Ya vimo que la
regla de las diagonales ofrece un medio sencillo para realizar dicho cálculo.
Para escribir la configuración electrónica de un átomo es necesario:
Saber el número de electrones que tiene el átomo; para ello basta conocer
el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z).
Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (nivel 1).
Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Supongamos que tenemos que averiguar la Distribución
electrónica en el elemento sodio, que como su número atómico indica
tiene 11 electrones, los pasos son muy sencillos: debemos seguir las
diagonales, como se representan más arriba.
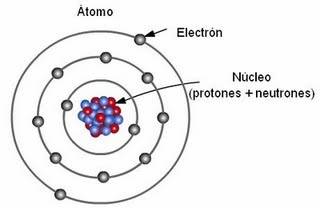 |
| Ilustración simplificada de un átomo. |
En el ejemplo del sodio sería: 1s
2, como siguiendo la diagonal no tengo nada busco la siguiente diagonal y tengo 2s
2, como siguiendo la diagonal no tengo nada busco la siguiente diagonal y tengo 2p
6, siguiendo la diagonal tengo 3s
2.
Siempre debo ir sumando los superíndices, que me
indican la cantidad de electrones. Si sumo los superíndices del ejemplo,
obtengo 12, quiere decir que tengo un electrón de más, ya que mi suma
para ser correcta debe dar 11, por lo que al final debería corregir
para que me quedara 3s
1.
Por lo tanto, para el sodio (11 electrones), el resultado es:
1s2 2s2 2p6 3s1
Primer nivel: 2 electrones (los 2 en subnivel s, en un orbital);
Segundo nivel: 8 electrones (2 en subnivel s, en un orbital, y 6
en subnivel p, con 2 en cada uno de sus 3 orbitales);
tercer nivel: 1 electrón (ubicado en el subnivel s, en un orbital).
;
En la tabla periódica podemos leer, respecto al sodio: 2 - 8 - 1
Otros ejemplos:
CLORO: 17 electrones
1s2 2s2 2p6 3s2 3p5
1º nivel: 2 electrones
2º nivel: 8 electrones
3º nivel: 7 electrones
En la tabla periódica podemos leer: 2 - 8 - 7 |
MANGANESO: 25 electrones
1s2 2s2 2p6 3s2 3p6 4s2 3d5
1º nivel: 2 electrones
2º nivel: 8 electrones
3º nivel: 13 electrones
4º nivel: 2 electrones
En la tabla periódica podemos leer: 2 - 8 - 13 – 2 |
El superíndice es el número de electrones de cada subnivel
(recordando siempre que en cada orbital del subnivel caben solo dos
electrones).
El Número máximo de electrones por nivel es
2(n)2 (donde n es la cantidad de subniveles que tiene cada nivel).
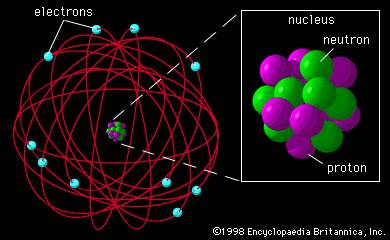 |
| Ilustración más compleja y más realista de la estructura de un átomo. |
Hagamos un ejercicio:
Supongamos que deseamos conocer la configuración electrónica de la plata, que tiene 47 electrones.
Por lo ya aprendido, sabemos que el orden de energía de los orbitales es 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, etc.
En cada subnivel
s (que tienen sólo un orbital) cabrán dos electrones.
En cada subnivel
p (que tienen 3 orbitales) cabrán 6 electrones.
En cada subnivel
d (que tienen 5 orbitales) cabrán 10 electrones.
En cada subnivel
f (que tienen 7 orbitales) cabrán 14 electrones.
Siguiendo esta regla debemos colocar los 47 electrones del átomo de plata, la cual debe quedar así::
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d9
donde sólo se han puesto 9 electrones en los orbitales
d (que son cinco) de la capa cuarta para completar, sin pasarse, los 47 electrones de la plata.
Recomendamos ver un video clarificador y explicativo en:
http://www.youtube.com/watch?v=hbn08dHJfGc
En él se aclara o explica cómo determinar la configuración electrónica de un átomo o de un ión:
1.- Conocer su número atómico (sacado de la tabla periódica).
2.- La carga (del átomo o del ión) está dada por número de protones menos (–) número de electrones.
3.- El número de protones es igual al número atómico del elemento (átomo o ión).
4.- En cada átomo hay (en estado eléctrico neutro) igual número de protones que de electrones.
Por ejemplo, el ión Mg
+2 (magnesio más dos),
averiguamos o sabemos que su número atómico (Z) es 12, significa que
tiene 12 protones y debería tener 12 electrones, pero como el ión de
nuestro ejemplo (Mg
+2) tiene carga +2 (porque perdió o cedió 2 electrones), hacemos
12 (protones) – X = 2
Por lo tanto X (número de electrones del ión Mg
+2) es igual a 10,
El ión Mg
+2 tiene 10 electrones.
¿Cómo se determina su configuración electrónica o lo que es lo
mismo cómo se distribuyen esos electrones en los orbitales del átomo?
Empezamos por el nivel inferior (el más cercano al núcleo): 1,
que sólo tiene un orbital s, y sabemos que cada orbital tiene como
máximo 2 electrones (1s
2).
Pasamos al segundo nivel, el 2, en el cual encontramos orbitales s (uno) y orbitales p (tres) (2s y 2p 2p 2p).
En 2s hay sólo 2 electrones: 2s
2 y en cada 2p hay dos electrones:
1s
2 2s
2 2p
6 (este 2p
6 es los mismo que 2p
2 + 2p
2 + 2p
2= 2p
6)
Otro ejemplo:
Configuración electrónica del fósforo (P)
Nº atómico Z = 15
15 protones y 15 electrones
1s
2 2s
2 2p
6 3s
2 3p
3
Relación de la Configuración electrónica con la Tabla Periódica
De modo inverso, si tenemos o conocemos la configuración electrónica de un elemento podemos predecir exactamente el
número atómico, el
grupo y el
período en que se encuentra el elemento en la tabla periódica.
Por ejemplo, si la configuración electrónica de un elemento es
1s2 2s2 2p6 3s2 3p5, podemos hacer el siguiente análisis:
Para un átomo la suma total de los electrones es igual al número de protones; es decir, corresponde a su
número atómico, que en este caso es 17. El
período en que se ubica el elemento está dado por el
máximo nivel energético de la configuración, en este caso corresponde al período 3, y el
grupo está dado por la suma de los electrones en los subniveles
s y
p del último nivel; es decir, corresponde al grupo 7.
Determinar la cantidad de protones y electrones
-
1
Busca en la tabla el elemento cuyo número de protones, neutrones y electrones estás tratando de averiguar.
-
2
Localiza el número atómico del elemento
en la tabla periódica. Lo encontrarás mirando en la esquina superior
izquierda de la casilla donde está el elemento. El número atómico te
informa del número de protones que tiene un determinado elemento.
-
3
Calcula el número de electrones usando
una vez más el número atómico. Un átomo contiene el mismo número de
protones que de electrones. Por lo tanto, el número atómico de un
elemento te indicará también cuántos electrones tiene.
Determinar la cantidad de neutrones
-
1
Localiza el número atómico del elemento cuya cantidad de neutrones deseas determinar.
-
2
Redondea la cifra que está en la parte
de arriba de la casilla del elemento (peso atómico) al número entero más
próximo. Por ejemplo, un peso atómico de 36,43 se debe redondear a 36,
mientras que uno de 75,78 se redondearía a 76.
-
3
Anota el resultado del redondeo.
-
4
Recuerda el número de protones o electrones que calculaste con anterioridad. (Recuerda: siempre va a ser el mismo número).
-
5
Resta el número de protones (o de
electrones) al número obtenido en el paso 3, el del redondeo del peso
atómico. Esto te dará la cantidad correcta de neutrones del elemento
objeto de tu estudio. Por ejemplo, si el número de protones era de 34 y
el peso atómico fue redondeado a 76, tendrás 76 - 34 = 42, que será el
número de neutrones del elemento
















 .
.