http://pendientedemigracion.ucm.es/info/diciex/programas/index.html
http://web.educastur.princast.es/proyectos/biogeo_ov/4a_ESO/index_4eso.htm
http://www.quimicaweb.net/grupo_trabajo_ccnn_2/tema1/index.htm
http://www.quimicaweb.net/grupo_trabajo_ccnn_2/index.html
UNIDAD
DIDÁCTICA 6
|
CAMBIOS QUÍMICOS EN LA MATERIA
|
|
1.- Transformaciones físicas y transformaciones químicas
Fenómenos o Cambios Físicos: Son procesos en los que no cambia
la naturaleza de las sustancias ni se forman otras nuevas.
Ejemplos:
Cambios de estado: Si
aplicamos una fuente de calor de forma constante, el agua hierve y se
transforma en vapor de agua. (En ambos casos, la sustancia implicada en el
proceso es agua que, en un caso está líquida y en el otro está gaseosa; esto
es, sus partículas están ordenadas de diferente manera según la teoría
cinética de la materia).
-
Mezclas: Si disolvemos sal en
agua observaremos que la sal se disuelve fácilmente en agua y la disolución
resultante presenta un gusto salado. (Las sustancias iniciales - sal y agua -
siguen presentes al final; este hecho es demostrable pues si calentamos la
disolución hasta que hierva el agua, nos queda la sal en el fondo).
Fenómenos o Cambios Químicos: Son procesos en los que cambia
la naturaleza de las sustancias, además de formarse otras nuevas.
Ejemplos:
-
Combustión: Si quemamos un
papel, se transforma en cenizas y, durante el proceso, se desprende humo.
(Inicialmente, tendríamos papel y oxígeno, al concluir el cambio químico
tenemos cenizas y dióxido de carbono, sustancias diferentes a las iniciales).
-
Corrosión: Si dejamos un
trozo de hierro a la intemperie, se oxida y pierde sus propiedades iniciales.
(Las sustancias iniciales serían hierro y oxígeno, la sustancia final es óxido
de hierro, con unas propiedades totalmente diferentes a las de las sustancias
iniciales).
2.- ¿Cómo sabemos cuándo se ha
producido una reacción química?
Cuando se
produce una reacción química suelen producirse algunos indicios típicos:
- Cambio
de coloración: Indica la aparición de una o de varias sustancias nuevas
distintas a las iniciales.
-
Aparición de sedimento o precipitado: Es señal de que una o algunas de las
sustancias nuevas formadas son insolubles.
-
Desprendimiento de gas: Como resultado de la reacción aparece una nueva
sustancia que se presenta en estado gaseoso a temperatura ambiente.
-
Absorción o liberación de calor: Los cambios espontáneos de temperatura de
la mezcla revelan que se está produciendo una reacción.
- Cambios
en otras propiedades: La acidez, el olor, la aparición de propiedades
ópticas frente a la luz, propiedades magnéticas o eléctricas, etc.
3.- ¿Cómo se representan las reacciones químicas?
Una reacción química es un proceso en
que, a partir de unas sustancias iniciales, llamadas reactivos, se
obtienen unas sustancias finales distintas, llamadas productos.
Reactivos: Son las sustancias
iniciales que, una vez mezcladas, reaccionan químicamente.
Productos: Son las sustancias
nuevas que se forman como resultado de la reacción química entre los reactivos.
Las reacciones químicas se escriben
mediante ecuaciones químicas: a la izquierda se escriben los reactivos
que se mezclan, separados por signos de sumar (+) y, a la derecha, los productos
que se obtienen, separados también por signos de sumar (+). Entre reactivos y
productos se coloca una flecha, que indica el sentido de la reacción.
REACTIVOS
→ PRODUCTOS
4.- La
masa no cambia durante las reacciones químicas
En una
reacción química la masa se conserva. Esto quiere decir que la masa total
de los productos obtenidos es igual a la masa total de los reactivos que han
reaccionado.
Ley de
las proporciones constantes: Los reactivos que participan en una reacción
química reaccionan siempre en proporciones fijas.
Ejemplo:
Si reaccionan hidrógeno y oxígeno para formar agua, siempre reaccionan 1 g de
hidrógeno por cada 8 g de oxígeno y esa siempre va a ser la proporción necesaria
para que formen agua. Las proporciones serían:
| HIDRÓGENO |
OXÍGENO |
AGUA |
| 1 g |
8 g |
9 g |
| 2 g |
16 g |
18 g |
| 3 g |
24 g |
27 g |
| 4 g |
32 g
|
36 g |
Y así sucesivamente. Si hay más cantidad de uno de
ellos se quedará sin reaccionar. Si ponemos 4 g de hidrógeno y 24 g de oxígeno,
sólo reaccionarán 3 g de hidrógeno con estos 24 de oxígeno y sobrará 1 g de
hidrógeno que se quedará sin reaccionar.
4.1.- Un modelo para explicar las leyes: los
átomos
En 1808, John Dalton ofreció una explicación de por
qué las reacciones químicas cumplen la ley de conservación de la masa y la de
las proporciones constantes. Se basa en las siguientes ideas:
- La materia está formada por átomos.
- Todos los átomos de un elemento son iguales, pero
distintos a los de otros elementos.
- En una reacción química, los átomos presentes
inicialmente se reorganizan de distinta manera formando sustancias diferentes.
Sin embargo, los átomos siguen siendo los mismos (ni se crean ni se destruyen),
de ahí que la masa no cambie en la reacción.
Desde el punto de vista atómico, en
una reacción química los átomos de las sustancias reactivas se reorganizan de
otra manera, dando lugar a nuevas sustancias que se denominan productos. Al no
cambiar el número ni la clase de átomos, la masa no cambia en la reacción.
4.2.- Ajuste de reacciones químicas
Para ajustar ecuaciones químicas hay
que tener en cuenta que en las reacciones ni se "ganan" ni se "pierden" átomos.
Debe aparecer el mismo número de átomos de cada clase en los reactivos y en los
productos. Esta es la condición de la conservación de la masa. sin embargo, no
podemos cambiar a voluntad las fórmulas de las sustancias para igualar el número
de átomos.
Ejemplo: Cuando el hierro se oxida se
origina un compuesto diferente llamado óxido de hierro (II). si escribimos la
reacción simbólicamente, tendremos:
Fe + O2
→ FeO
Tal y
como está escrita esta reacción 1 átomo de hierro reacciona con 2 átomos de
oxígeno formando 1 molécula con 1 átomo de hierro y 1 de oxígeno. Esto no puede
ser, tiene que haber el mismo número de átomos en ambos lados.
Por tanto, habrá que emplear unos
números llamados coeficientes que pondremos delante de cada fórmula o símbolo,
indicando el número de átomos de cada especie que deben reaccionar para que se
conserve la masa y el número de átomos:
Es decir, se necesitan 2 átomos de
hierro para reaccionar con una molécula de oxígeno y formar 2 moléculas de FeO.
Este proceso se llama ajustar una reacción química y consiste en anteponer los
números enteros necesarios delante de los símbolos o fórmulas de las sustancias
que intervienen en la reacción, de modo que se cumpla a escala atómica la ley de
conservación de la masa.
5.-
Balances de masa en las reacciones químicas
Masa
atómica
Los
átomos de distintos elementos tienen masas y tamaños diferentes. Los científicos
han establecido comparaciones entre las masas y los tamaños de los átomos hoy
conocidos.
La escala
de masas atómicas asigna masas a los átomos por comparación con la masa del
átomo de carbono, al que se le asigna el valor 12. La unidad de masa a escala
atómica se denomina unidad de masa atómica y se simboliza con u o
uma.
En las
tablas periódicas aparece la masa atómica en uma de cada elemento:
Masas
moleculares
Una
molécula es una agrupación de átomos de la misma o distinta clase. El número de
cada clase de átomos viene especificado en la fórmula de la sustancia. Por
ejemplo, la fórmula Fe2O3 significa que esta molécula está
formada por 2 átomos de hierro y 3 de oxígeno.
La masa
molecular se calcula sumando las masas atómicas de todos los átomos que
intervienen en la fórmula de la sustancia.
Por
tanto, la masa molecular del Fe2O3 será 56·2 + 16·3 = 160 uma.
Cálculos con reacciones químicas
Una
reacción ajustada indica las proporciones en las que participan las diversas
sustancias. Teniendo en cuenta las masas atómicas o moleculares de las
sustancias, podemos establecer qué cantidad (en masa) de cada sustancia
interviene en la reacción.
Ejemplo:
2 Fe +
O2 → 2 FeO
Consultando una tabla periódica podemos ver que la masa atómica del Fe es 56 uma
y la masa molecular del O2 es 32 uma, mientras que la masa del FeO es
56 + 16 = 72 uma. Al observar la reacción ajustada, vemos que la relación de
masas que intervienen en la reacción es:
2 ·
masa Fe + masa O2 → 2 · masa FeO
Es decir:
2 · 56 + 32 →
2 · 72
La misma
relación de masas atómicas o moleculares se cumple tanto en unidades de masa
atómica como en gramos o en kilogramos. Por tanto, se puede afirmar que 112 g de
hierro reaccionan con 32 g de oxígeno atmosférico para producir 144 g de FeO.
Procedimiento de cálculo con reacciones químicas
1.-
Ajusta la reacción química.
2.-
Determina las masas atómicas o moleculares de las sustancias que intervienen.
3.-
Multiplica dichas masas por los correspondientes números enteros que has escrito
antes para ajustar la reacción.
4.- Los
valores obtenidos, expresados en cualquier unidad de masa, indican las
cantidades de reactivo y de producto que intervienen en la reacción.
6.- La
energía en las reacciones químicas
En
general, cuando se forma una sustancia estable (que perdura en el tiempo) a
partir de sus elementos, se libera energía, normalmente en forma de energía
térmica. Por el contrario, para destruir una sustancia estable, se necesitará
aportar energía. Según el balance energético, las reacciones se clasifican en:
Reacción
endotérmica: Es aquélla que necesita un aporte de energía para producirse.
Ejemplo: Descomposición del clorato
potásico para obtener cloruro potásico y oxígeno.
Reacción
exotérmica: Es aquélla que libera energía térmica mientras se produce.
Ejemplo: Combustión del butano para obtener energía térmica para calentar
agua.
Actividades
ENLACES
QUÍMICOS
La estructura de la corteza de los átomos, de forma especial
la de la última capa, determina como se unen entre si los
átomos para formar estructuras más estables dando
lugar a los compuestos químicos.
Existen
varias estructuras estables pero para la formación de los
compuestos químicos más frecuentes en la naturaleza
se podría considerar que la estructura estable es la que
corresponde a los elementos de la columna 18 de la tabla periódica,
también llamados por su estabilidad gases nobles, que se
caracterizan por tener 8 electrones en la última capa, salvo
el helio que tiene solo dos. Al unirse entre sí los átomos
cogen, ceden o comparten electrones para adquirir esa estructura.
El número de electrones que cogen, ceden o comparten es lo
que se conoce con el nombre de valencia de ese elemento.
Simplificando podríamos considerar tres tipos de unión
de los átomos:
|
TIPO
DE UNIÓN
|
¿QUÉ
SUCEDE?
|
SITUACIÓN
EN LA TABLA PERIÓDICA DE LOS ELEMENTOS
|
NOMBRE
DEL ENLACE
|
|
UN
ÁTOMO CEDE ELECTRONES Y EL OTRO LOS COGE
|
SE
FORMAN IONES POSITIVOS Y NEGATIVOS QUE PERMANECEN ATRAÍDOS
FUERTEMENTE POR LA FUERZA DE COULOMB
|
LOS
ELEMENTOS DE LA IZQUIERDA DE LA TABLA CON LOS DE LA DERECHA
|
IÓNICO
|
|
SE
COMPARTEN ELECTRONES
|
NO
SE FORMAN IONES. PUEDE HABER UN DESPLAZAMIENTO DE LOS ELECTRONES
HACIA UNO DE LOS ELEMENTOS PORQUE TIRE MÁS DE ELLOS.
SE FORMARÁ UNA MOLÉCULA CON DOS POLOS, UNO POSITIVO
Y EL OTRO NEGATIVO.
|
LOS
ELEMENTOS DE LA DERECHA DE LA TABLA ENTRE SI
|
COVALENTE
|
|
CEDEN
ELECTRONES
|
ATMÓSFERA
DE ELECTRONES CON IONES POSITIVOS EN MEDIO. FUERZA DE COULOMB.
|
LOS
ELEMENTOS DE LA IZQUIERDA DE LA TABLA ENTRE SI
|
METÁLICO
|
PROPIEDADES
DE LOS COMPUESTOS SEGÚN SU ENLACE
Las
propiedades de las sustancia a las que dan lugar se pueden recordar
pensando en las características de sustancias que se conocen
de la vida corriente.
|
ENLACE
|
EJEMPLO
|
PROPIEDADES
|
|
IÓNICO
|
SAL
DE MESA
|
SÓLIDO
DE TEMPERATURA DE FUSIÓN ALTA. SOLUBLE EN AGUA. CUANDO
ESTÁ DISUELTO O FUNDIDO CONDUCE LA CORRIENTE ELÉCTRICA
DESCOMPONIÉNDOSE.
|
|
COVALENTE
|
ACEITE
|
TEMPERATURA
DE FUSIÓN BAJA. COLOREADO. INSOLUBLE EN AGUA PERO SOLUBLE
EN OTROS COVALENTES. NO CONDUCE LA CORRIENTE ELÉCTRICA.
|
|
METÁLICO
|
PLATA
|
SÓLIDO
DE TEMPERATURA DE FUSIÓN ALTA (EXCEPTO
Hg). BLANCO O INCOLORO (EXCEPTO Au y Cu). CONDUCE
LA CORRIENTE ELÉCTRICA SIN DESCOMPONERSE.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 .
. .
.
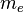 es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita. , del electrón sea un múltiplo entero de
, del electrón sea un múltiplo entero de 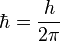 Esta condición matemáticamente se escribe:
Esta condición matemáticamente se escribe:
 y queda la condición de cuantización para los radios permitidos:
y queda la condición de cuantización para los radios permitidos: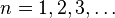 ;
subíndice introducido en esta expresión para resaltar que el radio
ahora es una magnitud discreta, a diferencia de lo que decía el primer
postulado.
;
subíndice introducido en esta expresión para resaltar que el radio
ahora es una magnitud discreta, a diferencia de lo que decía el primer
postulado. , número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr: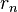 en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido: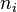 identifica la órbita inicial y
identifica la órbita inicial y 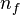 la final, y
la final, y 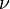 es la frecuencia.
es la frecuencia. , y donde
, y donde 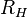 es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso
es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso  , es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (
, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg ( ), coincide con el valor de la fórmula teórica.
), coincide con el valor de la fórmula teórica.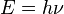 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.