"Educar a un joven no es hacerle aprender algo que no sabía, sino hacer de él alguien que no existía." John Ruskin
http://yenka.com/register/confirm.action?t=ff8080814cff3c24014fa68483c20392
Clase Invertida
FLIPPED CLASSROOM
INICIAMOS EL APRENDIZAJE ENTRE PARES
REALIZA EN HOJAS A4, LAS TAREAS PROPUESTAS EN LA SIGUIENTE WEBQUEST
http://www.catedu.es/crear_wq/wq/home/3183/index.html
EL ÁTOMO :DOCUMENTAL COMPLETO
Observa video
PRESENTA RESUMEN EN TU CUADERNO 1 CARILLA, hasta el 27 /11/2015
%%%%%%%%%%%%%%
%%%%%%%%%%%%%%
PREPARA TU EXAMEN PARCIAL
HASTA PROPIEDADES PERIÓDICAS
METALES Y NO METALES :
RADIO ATOMICO Y IÓNICO
 .
.
 .
.
.
.
.
TABLA PERIÓDICA
OBSERVA, ANALIZA Y REALIZA LA TAREA EN TU CUADERNO DE MATERIA (4,5 Y 6 DE NOV)
Sigue paso a paso la secuencia y tendras éxito en el estudio,
ESCENARIO, TAREA, PRODUCTO, EVALUACIÓN
recuerda los recursos propuestos optimizan tu tiempo, obsrévalos
ENTRE Y TRABAJE
http://www.iticlab.es/majwq/wq/veremini/338
&&&&&&&&&&&&&&
PARA SU CUADERNO "DEBER"

.

ENTRE Y TRABAJE
http://www.iticlab.es/majwq/wq/veremini/338
&&&&&&&&&&&&&&
SE REVISARA EL VIERNES 6 DE NOVIEMBRE
RECONOCE ALGUNOS ELEMENTOS QUÍMICOS
Oxígeno Proyecto ARTomico
Protactinio ProyectoARTómico
Cobre Proyecto ARTómico
Boro Proyecto ARTomico
Helio con subtítulos Proyecto ARTomico
PARA VARIAR
¿QUÉ HACE QUE LOS CUERPOS CAIGAN?
WE ARE AMAZING!
%%%%%%%%%%%%%%%%%%%%%%%%%
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
%%%%%%%%%%%%%%%%%%%%%%%%%%
AGREGAR A SU CUADERNO UNO DE LOS MAPAS CONCEPTUALES PARA FINALIZAR
Separación de mezclas


separación de mezclas de líquidos


%%%%%%%
Decantación

%%%

%%%%%%%
separación sólidoliquido
 .
.

%%%%%%%%%%%%
.Cromotografía

Transformación de la Materia
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
%%%%%%%%%%%%%%%%%%%%%%%%%%
AGREGAR A SU CUADERNO UNO DE LOS MAPAS CONCEPTUALES PARA FINALIZAR
Separación de mezclas
separación de mezclas de líquidos
%%%%%%%
Decantación
%%%
%%%%%%%
separación sólidoliquido
 .
.%%%%%%%%%%%%
.Cromotografía
Transformación de la Materia
Objetivos
1. Conocer la estructura y
características de la materia para distinguir los elementos y compuestos químicos
más comunes de la naturaleza y comprender
que la materia se transforma constantemente a través de reacciones químicas e
interpretar esas reacciones y su
interacción en la conservación de la masa.

y




%%%%%%%%%%%%%%%%%%%%%%%%
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
PROÍEDADES DE LA MATERÍA

y

%%%%%%%%%%%%%%%%%%%%%%%%
Estados de la materia
Observe el video.
%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%%
PROÍEDADES DE LA MATERÍA


Propiedad Física: impenetrabilidad

Cuando un cuerpo ocupa un espacio, ningún otro cuerpo puede estar en ese
mismo espacio, porque la materia es impenetrable. Cuando mojamos una
esponja, el agua y la esponja no ocupan el mismo sitio, es que la
esponja está llena de huecos, llamados poros, en los que se coloca el
agua

Para medir el volumen de los líquidos se emplean probetas, recipientes
de vidrio o plástico con una graduación. Al verter en ellas el líquido,
el nivel que alcanza indica el volumen de líquido que contiene.
También es posible medir el volumen de sólidos. Para ello se llena la
probeta hasta un nivel determinado, después se pone en su interior el
sólido, con lo que subirá el volumen que marca. La diferencia entre los
volúmenes marcados después y antes de introducir el sólido será el
volumen de éste.
Las figuras geométricas tienen fórmulas que permiten calcular su
volumen midiendo sus dimensiones.
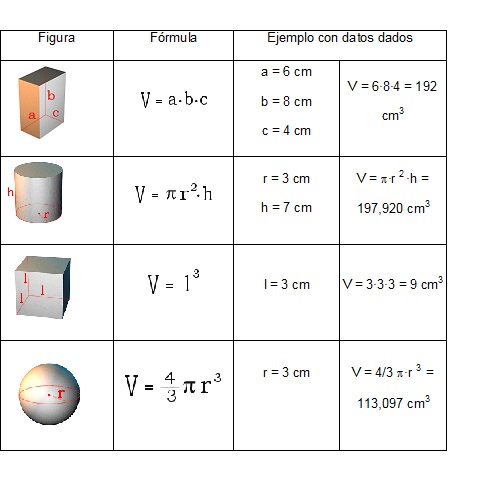
Autoevaluación
https://marthajanethvasquez.wordpress.com/propiedades-de-la-materia/
TRABAJO EN EL AULA
BLOQUE 2 : UNIDAD No 3




ROTULA 5 PROPIEDADES
COMPLETA
 .
.
 QUEST : No 2
QUEST : No 2
LA QUÍMICA Y OTRAS CIENCIAS
INTRODUCCIÓN.
Realiza una breve lectura comprensiva de la información que se detalla luego y pocras adquirir valiososconocimientos sobre la relación de la química con otras ciencias, el campo de estudio de la química y su realación con otras ciencias.
TAREA
- ELABORA UN DIAGRAMA DE LA REALACIÓN DE LA QUÍMICA CON OTRAS CIENCIAS
- EN UNA RUEDA DE ATRIBUTOS EXPLICA EL CAMPO DE ESTUDIO DE LA QUÍMICA.
- ELABORA UN ORGANIZADOR CON LA DIVISIÓN DE LA QUÍMICA
PROCESO
- Lectura comprensiba de información adicional
- Lee y apoyate en la lectura de :
Relación con otras ciencias: http://quiimicca1.blogspot.com/2012/10/ciencias-que-se-relacionan-con-la.html
EVALUACIÓN
Verificación en el diario de aprendizaje:(cuaderno de materia)
- Presentación
- Organización
CONCLUSIÓN
EXPLICA Y VALORA EL CONOCIMIENTO ADQUIRIDO.
%%%%%%%%%%%%%%
RELACIÓN DE LA
QUÍMICA CON OTRAS CIENCIAS
Originalmente solo existía una
Ciencia Natural. Con la adquisición de nuevos conocimientos, ésta se dividió en
diversas ramas, dando lugar a las cuatro ciencias naturales clásicas: Física,
Química, Biología y Geología. Desarrollos posteriores de las Ciencias Naturales
clásicas dieron lugar a nuevas especialidades: Bioquímica, Biofísica,
Geoquímica, Geofísica, Físico-química
“Relación de
la Química con otras Ciencias”
La química se relaciona con diferentes ciencias
como la física, la astronomía, la biología, entre otras. Gracias a esta
interrelación es posible explicar y comprender los complejos fenómenos de la
naturaleza.

CAMPO DE ESTUDIO DE LA QUÍMICA
La química cubre un campo de
estudios bastante amplio, por lo que en la práctica se estudia de cada tema de
manera particular. Las seis principales y más estudiadas ramas de la química
son:
Química inorgánica: síntesis y estudios de las propiedades
eléctricas, magnéticas y ópticas de los compuestos formados por átomos que no
sean de carbono (aunque con algunas excepciones). Trata especialmente los
nuevos compuestos con metales de transición, los ácidos y las bases, entre
otros compuestos.
Química orgánica: Síntesis y estudios de los compuestos que se
basan en cadenas de carbono.
Bioquímica: estudia las relaciones químicas en los seres vivos,
estudia el organismo y los seres vivos.
Química física: estudia los fundamentos y bases físicas de los
sistemas y procesos químicos. En particular, son de interés para el químico
físico los aspectos energéticos y dinámicos de tales sistemas y procesos. Entre
sus áreas de estudio más importantes se incluyen la termodinámica química, la
cinética química, la electro química, la mecánica estadística y la
espectroscopia. Usualmente se la asocia también con la química cuántica y la
química teórica.
Química industrial: Estudia los métodos de producción de reactivos
químicos en cantidades elevadas, de la manera económicamente más beneficiosa.
Química analítica: estudia los métodos de detección y
cuantificación de una sustancia en una muestra. Se subdivide en cuantitativa y
cualitativa.
Además existen múltiples subdisciplinas que, por ser demasiado
específicas o bien multiplicidades, se estudian individualmente como:
-
Astroquimica
-
Electro-química
-
Foto-química
-
Magneto-química
-
Nanoquímica (relacionada con la nanotecnología)
- Petroquímica
-
Geoquímica
- Química
Computacional
- Química
Cuántica
- Química
Macro-molecular
- Química
Nuclear
- Química
Organometálica
- Química
Teorica
División de la Química
El campo de estudio de la Química
es muy extenso. Por esta razón se la ha dividido en diversas ramas.
Química general.- Trata los principios teóricos como leyes, reglas
y teorías que explican la composición y comportamiento de la materia y energía.
Química descriptiva.- Estudia la composición, propiedades y métodos
de obtención de las distintas sustancias. Ésta a su vez se divide en:
Química
orgánica.- Estudia los compuestos que contienen carbono en su estructura.
Química
inorgánica.- Estudia la estructura, composición y reacciones químicas de
las sustancias inorgánicas.
Química analítica.- Estudia los componentes de una muestra y la
cantidad en que se encuentran. Puede ser:
Cualitativa.- Permite
identificar la presencia de los componentes de una sustancia.
Cuantitativa.-
Determina la cantidad que interviene en una sustancia.
Química aplicada.- Se refiere a la interacción de la Química con
otras ciencias, como Física, Biología, Geología, Astronomía; y también con
otras áreas del conocimiento, como medicina, agricultura, ingeniería,
veterinaria, mineralogía.
Bioquímica.-
Estudia la composición química de las sustancias presentes en los seres vivos y
sus reacciones químicas.
Fisicoquímica.-
Estudia las propiedades físicas y los cambios que modifican la estructura de la
materia.
Geoquímica.- Estudia la composición y
estructura de los elementos químicos del planeta Tierra.
Petroquímica.-
Estudia el petróleo y el gas natural como materia prima para la obtención de
distintos productos químicos.
Agroquímica.- Estudia la utilización de
productos químicos en la agricultura como, como abonos, herbicidas, etc. y de
uso industrial de materias orgánicas procedentes de explotaciones agrarias:
como aceites, residuos, etc.
Astroquímica.-
Estudia la composición química del material interestelar.
Mineralogía.-
Estudia el comportamiento e interacción de los minerales
Introducción a las Webquest
- See more at: http://www.webquest.es/#overlay=admin/dashboard_usuario
.
.
Alfred Nobel.
.
CALOR Y TEMPERATURA
.
COMPRUEBA EN CASA EL EXPERIMENTO.
EXPERIMENTO 1
EXPERIMENTO 2
EXPERIMENTO 3
ESCALAS TERMOMÉTRICAS
Experimente conversiones a las escalas, CELSIUS, FAHRENHEIT Y KELVIN en la siguiente dirección:
http://www.educaplus.org/play-116-Escalas-termom%C3%A9tricas.html
Introducción a las Webquest
- See more at: http://www.webquest.es/#overlay=admin/dashboard_usuario
http://www.webquest.es/wq/relacion-de-la-quimica-con-otras-ciencias
SEGUIMOS
videos
MASA Y PESO
.
2
Diferencia entre peso y masa
3
Estamos listos para ineractuar en el aula.
http://www.aaamatematicas.com/dec71jx2.htm
Ejercicios de cálculo de notación cientifica en dirección anterior
LECTURA .
Más o menos 250 A.C., el matemático griego Arquímedes recibió la tarea de determinar si
un artesano había defraudado al Rey de Siracusa cuando cambió una
medida de oro en la corona del Rey por una de plata. Arquímedes
reflexionó sobre el problema mientras se relajaba en una piscina. Ahí se
dio cuenta que el agua se desparramaba a los lados de la piscina.
Arquímedes tuvo una epifanía (una relevación). Se dio cuenta que la
cantidad de agua que se desparramaba era igual en volúmen que el espacio
que su ocupaba cuerpo. De repente este hecho le dio el método para
diferenciar una corona de oro y plata de una corona de puro oro. Ya que
la medida de la plata ocupa más espacio que el equivalente de la medida
de oro, Arquímedes puso la corona del artesano y una corona equivalente
de puro oro en dos tubos de agua. Encontró que se desparramaba más agua
del tubo cuando la corona del artesano estaba adentro. Resulta que el
artesano había estado defraudando al Rey. La leyenda dice que Arquímedes
estaba tan entusiasmado con su descubrimiento que corrió desnudo por
las calles de Grecia gritando Eureka! Eureka! (La palabra griega que
significa 'Lo encontré').
Arquímedes había usado el concepto de densidad
para exponer este fraude. La densidad es una propiedad física de la
materia que describe el grado de compacidad de una substancia. La
densidad describe cuán unidos están los átomos de un elemento o las moléculas de un compuesto.
Mientras más unidas están las partículas individuales de una
substancia, más densa es la substancia.
Puesto que las diferentes
substancias tienen densidades diferentes, la medidas de la densidad son
una vía útil para identificar las substancias.
Por ejemplo, ¿cómo distinguir una tonelada
métrica de plumas de una tonelada métrica de ladrillos ?
http://www.visionlearning.com/es/library/Ciencias-Generales/3/Densidad/37
La densidad del Aluminio es 2,70 g/cm3 . ¿Qué volumen ocupará una
masa de 5 Kg? exprese la respuesta en notación cientifica y con 3 CS
DATOS
d=
V=
m=
d=m/v
Ecuación para calcular el volumen: V= m/d
Estrategia:
1) como la masa se expresa en Kg, debe convertir a: g
2) aplica la ecuación y obtendrá el volumen en cm3
&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&
&&&&&&&&&&&&&&&
WEBQUEST : No 1
INICIAMOS CON LA PRIMERA FLIPPED CLASSDOOM
Sistema Internacional de Unidades y
Notación Científica
Magnitudes Físicas y Químicas.
INICIAMOS LA TAREA DE APRENDIZAJE
DATOS DE LA
WEBQUEST
A lo largo de la siguiente
webquest podemos
conocer los siguientes conceptos:
·
Sistema
Internacional de Unidades
·
Magnitudes
físicas y químicas
·
Notación
científica
- INTRODUCCIÓN:
Una de las características fundamentales del
conocimiento científico es la Medida de las magnitudes o
propiedades de la materia que se pueden medir. Las magnitudes pueden ser fundamentales o derivadas y van
acompañadas de una unidad de
medida. Para que todos los países utilicen la misma unidad de medida se
utilizan las unidades del Sistema Internacional y
sus múltiplos y submúltiplos. La manera correcta de expresar una cantidad medida es utilizando la notación científica. Esto lo aprenderemos con un trabajo organizado
2. TAREA
Luego de observar los videos o consultar las páginas web citadas en el
apartado de recursos, contesta el siguiente cuestionario en tu diario de aprendizaje o cuaderno.
- ¿Qué es una magnitud?
- ¿En qué se diferencia una magnitud fundamental de una derivada? ejm.
- Cuál es la función del Sistema Internacional de Unidades?
- ¿Qué es el Sistema Internacional de Unidades?
- Escribe en una tabla de doble entrada el nombre de las siete magnitudes fundamentales del SI con sus unidades.
- ¿Cuáles son las unidades de la masa, la longitud, el tiempo y la temperatura Y LOS MÚLTIPLOS Y SUBMÚLTIPLOS según el SI?
- Distingue cuáles de las siguientes son magnitudes fundamentales y cuáles
son derivadas:
mol, velocidad, densidad,
volumen, tiempo, masa. Escribe también sus unidades en
el SI
LA PREGUNTA 8 SE REALIZARÁ EN EL AULA LUEGO DE LA EXPLICACIÓN Y DEMOSTRACIÓN.
8.
Escribe en notación científica
las siguientes magnitudes:
ROTULA 5 PROPIEDADES
COMPLETA
 .
.
 QUEST : No 2
QUEST : No 2
COMPLETA
 .
.
 QUEST : No 2
QUEST : No 2
COMPLETA
 .
.
 QUEST : No 2
QUEST : No 2
LA QUÍMICA Y OTRAS CIENCIAS
INTRODUCCIÓN.
Realiza una breve lectura comprensiva de la información que se detalla luego y pocras adquirir valiososconocimientos sobre la relación de la química con otras ciencias, el campo de estudio de la química y su realación con otras ciencias.
TAREA
- ELABORA UN DIAGRAMA DE LA REALACIÓN DE LA QUÍMICA CON OTRAS CIENCIAS
- EN UNA RUEDA DE ATRIBUTOS EXPLICA EL CAMPO DE ESTUDIO DE LA QUÍMICA.
- ELABORA UN ORGANIZADOR CON LA DIVISIÓN DE LA QUÍMICA
PROCESO
- Lectura comprensiba de información adicional
- Lee y apoyate en la lectura de :
EVALUACIÓN
Verificación en el diario de aprendizaje:(cuaderno de materia)
- Presentación
- Organización
CONCLUSIÓN
EXPLICA Y VALORA EL CONOCIMIENTO ADQUIRIDO.
%%%%%%%%%%%%%%
RELACIÓN DE LA
QUÍMICA CON OTRAS CIENCIAS
Originalmente solo existía una
Ciencia Natural. Con la adquisición de nuevos conocimientos, ésta se dividió en
diversas ramas, dando lugar a las cuatro ciencias naturales clásicas: Física,
Química, Biología y Geología. Desarrollos posteriores de las Ciencias Naturales
clásicas dieron lugar a nuevas especialidades: Bioquímica, Biofísica,
Geoquímica, Geofísica, Físico-química
“Relación de
la Química con otras Ciencias”
La química se relaciona con diferentes ciencias
como la física, la astronomía, la biología, entre otras. Gracias a esta
interrelación es posible explicar y comprender los complejos fenómenos de la
naturaleza.
CAMPO DE ESTUDIO DE LA QUÍMICA
La química cubre un campo de
estudios bastante amplio, por lo que en la práctica se estudia de cada tema de
manera particular. Las seis principales y más estudiadas ramas de la química
son:
Química inorgánica: síntesis y estudios de las propiedades
eléctricas, magnéticas y ópticas de los compuestos formados por átomos que no
sean de carbono (aunque con algunas excepciones). Trata especialmente los
nuevos compuestos con metales de transición, los ácidos y las bases, entre
otros compuestos.
Química orgánica: Síntesis y estudios de los compuestos que se
basan en cadenas de carbono.
Bioquímica: estudia las relaciones químicas en los seres vivos,
estudia el organismo y los seres vivos.
Química física: estudia los fundamentos y bases físicas de los
sistemas y procesos químicos. En particular, son de interés para el químico
físico los aspectos energéticos y dinámicos de tales sistemas y procesos. Entre
sus áreas de estudio más importantes se incluyen la termodinámica química, la
cinética química, la electro química, la mecánica estadística y la
espectroscopia. Usualmente se la asocia también con la química cuántica y la
química teórica.
Química industrial: Estudia los métodos de producción de reactivos
químicos en cantidades elevadas, de la manera económicamente más beneficiosa.
Química analítica: estudia los métodos de detección y
cuantificación de una sustancia en una muestra. Se subdivide en cuantitativa y
cualitativa.
Además existen múltiples subdisciplinas que, por ser demasiado
específicas o bien multiplicidades, se estudian individualmente como:
- Astroquimica
- Electro-química
- Foto-química
- Magneto-química
- Nanoquímica (relacionada con la nanotecnología)
- Petroquímica
- Geoquímica
- Química Computacional
- Química Cuántica
- Química Macro-molecular
- Química Nuclear
- Química Organometálica
- Química Teorica
División de la Química
El campo de estudio de la Química
es muy extenso. Por esta razón se la ha dividido en diversas ramas.
Química general.- Trata los principios teóricos como leyes, reglas
y teorías que explican la composición y comportamiento de la materia y energía.
Química descriptiva.- Estudia la composición, propiedades y métodos
de obtención de las distintas sustancias. Ésta a su vez se divide en:
Química
orgánica.- Estudia los compuestos que contienen carbono en su estructura.
Química
inorgánica.- Estudia la estructura, composición y reacciones químicas de
las sustancias inorgánicas.
Química analítica.- Estudia los componentes de una muestra y la
cantidad en que se encuentran. Puede ser:
Cualitativa.- Permite
identificar la presencia de los componentes de una sustancia.
Cuantitativa.-
Determina la cantidad que interviene en una sustancia.
Química aplicada.- Se refiere a la interacción de la Química con
otras ciencias, como Física, Biología, Geología, Astronomía; y también con
otras áreas del conocimiento, como medicina, agricultura, ingeniería,
veterinaria, mineralogía.
Bioquímica.-
Estudia la composición química de las sustancias presentes en los seres vivos y
sus reacciones químicas.
Fisicoquímica.-
Estudia las propiedades físicas y los cambios que modifican la estructura de la
materia.
Geoquímica.- Estudia la composición y
estructura de los elementos químicos del planeta Tierra.
Petroquímica.-
Estudia el petróleo y el gas natural como materia prima para la obtención de
distintos productos químicos.
Agroquímica.- Estudia la utilización de
productos químicos en la agricultura como, como abonos, herbicidas, etc. y de
uso industrial de materias orgánicas procedentes de explotaciones agrarias:
como aceites, residuos, etc.
Astroquímica.-
Estudia la composición química del material interestelar.
Mineralogía.-
Estudia el comportamiento e interacción de los minerales
Introducción a las Webquest
.
.
Alfred Nobel.
.
.
.
Alfred Nobel.
.
.
.
Alfred Nobel.
.
CALOR Y TEMPERATURA
.
COMPRUEBA EN CASA EL EXPERIMENTO.
EXPERIMENTO 1
EXPERIMENTO 2
EXPERIMENTO 3
ESCALAS TERMOMÉTRICAS
Experimente conversiones a las escalas, CELSIUS, FAHRENHEIT Y KELVIN en la siguiente dirección:
http://www.educaplus.org/play-116-Escalas-termom%C3%A9tricas.html
CALOR Y TEMPERATURA
.
COMPRUEBA EN CASA EL EXPERIMENTO.
EXPERIMENTO 1
EXPERIMENTO 2
EXPERIMENTO 3
ESCALAS TERMOMÉTRICAS
Experimente conversiones a las escalas, CELSIUS, FAHRENHEIT Y KELVIN en la siguiente dirección:
http://www.educaplus.org/play-116-Escalas-termom%C3%A9tricas.html
CALOR Y TEMPERATURA
.
COMPRUEBA EN CASA EL EXPERIMENTO.
EXPERIMENTO 1
EXPERIMENTO 2
EXPERIMENTO 3
ESCALAS TERMOMÉTRICAS
Experimente conversiones a las escalas, CELSIUS, FAHRENHEIT Y KELVIN en la siguiente dirección:
http://www.educaplus.org/play-116-Escalas-termom%C3%A9tricas.html
Introducción a las Webquest
SEGUIMOS
videos
MASA Y PESO
.
2
Diferencia entre peso y masa
3
Estamos listos para ineractuar en el aula.
http://www.aaamatematicas.com/dec71jx2.htm
Ejercicios de cálculo de notación cientifica en dirección anterior
LECTURA .
Más o menos 250 A.C., el matemático griego Arquímedes recibió la tarea de determinar si
un artesano había defraudado al Rey de Siracusa cuando cambió una
medida de oro en la corona del Rey por una de plata. Arquímedes
reflexionó sobre el problema mientras se relajaba en una piscina. Ahí se
dio cuenta que el agua se desparramaba a los lados de la piscina.
Arquímedes tuvo una epifanía (una relevación). Se dio cuenta que la
cantidad de agua que se desparramaba era igual en volúmen que el espacio
que su ocupaba cuerpo. De repente este hecho le dio el método para
diferenciar una corona de oro y plata de una corona de puro oro. Ya que
la medida de la plata ocupa más espacio que el equivalente de la medida
de oro, Arquímedes puso la corona del artesano y una corona equivalente
de puro oro en dos tubos de agua. Encontró que se desparramaba más agua
del tubo cuando la corona del artesano estaba adentro. Resulta que el
artesano había estado defraudando al Rey. La leyenda dice que Arquímedes
estaba tan entusiasmado con su descubrimiento que corrió desnudo por
las calles de Grecia gritando Eureka! Eureka! (La palabra griega que
significa 'Lo encontré').
Arquímedes había usado el concepto de densidad
para exponer este fraude. La densidad es una propiedad física de la
materia que describe el grado de compacidad de una substancia. La
densidad describe cuán unidos están los átomos de un elemento o las moléculas de un compuesto.
Mientras más unidas están las partículas individuales de una
substancia, más densa es la substancia.
Puesto que las diferentes
substancias tienen densidades diferentes, la medidas de la densidad son
una vía útil para identificar las substancias.
Por ejemplo, ¿cómo distinguir una tonelada
métrica de plumas de una tonelada métrica de ladrillos ?
http://www.visionlearning.com/es/library/Ciencias-Generales/3/Densidad/37
DATOS
d=
V=
m=
d=m/v
Ecuación para calcular el volumen: V= m/d
Estrategia:
1) como la masa se expresa en Kg, debe convertir a: g
2) aplica la ecuación y obtendrá el volumen en cm3
d=
V=
m=
d=m/v
Ecuación para calcular el volumen: V= m/d
Estrategia:
1) como la masa se expresa en Kg, debe convertir a: g
2) aplica la ecuación y obtendrá el volumen en cm3
&&&&&&&&&&&&&&&
WEBQUEST : No 1
INICIAMOS CON LA PRIMERA FLIPPED CLASSDOOM
WEBQUEST : No 1
Sistema Internacional de Unidades y Notación Científica
Magnitudes Físicas y Químicas.
INICIAMOS LA TAREA DE APRENDIZAJE
DATOS DE LA
WEBQUEST
A lo largo de la siguiente webquest podemos
conocer los siguientes conceptos:
·
Sistema
Internacional de Unidades
·
Magnitudes
físicas y químicas
·
Notación
científica
- INTRODUCCIÓN:
Una de las características fundamentales del
conocimiento científico es la Medida de las magnitudes o
propiedades de la materia que se pueden medir. Las magnitudes pueden ser fundamentales o derivadas y van
acompañadas de una unidad de
medida. Para que todos los países utilicen la misma unidad de medida se
utilizan las unidades del Sistema Internacional y
sus múltiplos y submúltiplos. La manera correcta de expresar una cantidad medida es utilizando la notación científica. Esto lo aprenderemos con un trabajo organizado
2. TAREA
Luego de observar los videos o consultar las páginas web citadas en el
apartado de recursos, contesta el siguiente cuestionario en tu diario de aprendizaje o cuaderno.
- ¿Qué es una magnitud?
- ¿En qué se diferencia una magnitud fundamental de una derivada? ejm.
- Cuál es la función del Sistema Internacional de Unidades?
- ¿Qué es el Sistema Internacional de Unidades?
- Escribe en una tabla de doble entrada el nombre de las siete magnitudes fundamentales del SI con sus unidades.
- ¿Cuáles son las unidades de la masa, la longitud, el tiempo y la temperatura Y LOS MÚLTIPLOS Y SUBMÚLTIPLOS según el SI?
- Distingue cuáles de las siguientes son magnitudes fundamentales y cuáles son derivadas: mol, velocidad, densidad, volumen, tiempo, masa. Escribe también sus unidades en el SI
LA PREGUNTA 8 SE REALIZARÁ EN EL AULA LUEGO DE LA EXPLICACIÓN Y DEMOSTRACIÓN.
8.
Escribe en notación científica
las siguientes magnitudes:- 125.000.000 Km,= 1.25(10)8 Km
- 3.040.000 s,.............................................
- 0,0000005 m,..........................................
- 0,00000207 Kg,......................................
3. PROCESOS Y RECURSOS
Para interactuar y trabajar la web quest, por favor copia uno de los sigientes link, pega en la pestaña principal e inicia tu aprendizaje
Fundamentación teórica:
http://www.100ciaquimica.net/temas/tema1/index.htm
SI LO PREFIERES OBSERVA EL VIDEO
SISTEMA INTERNACIONAL DE UNIDADES
OBSERVACIÓN OPCIONAL
LONGITUD , CAPACIDAD , MASA , SUPERFICIE Y VOLUMEN
( VIDEO COMPLETO 1H00)
Luego puedes observar los videos sigientes para confirmar tus aprendizajes.
¿QUÉ ES LA MASA?
LA MASA PASO A PASO DIFERENCIA ENTRE KILO y LITRO
MASA y VOLUMEN PASO A PASO
CÓMO MEDIR EL VOLUMEN DE UN OBJETO PASO A PASO
.
4. EVALUACIÓN:
Su trabajo para ser calificado exelente debe tener muy buena;
PRESENTACIÓN
ORGANIZACIÓN
RIGOR CIENTÍFICO DE LA INFORMACIÓN
CALIGRAFÍA YORTOGRAFÍA
CONCLUSIÓN.
Luego de realizado
este trabajo, con agilidad reconoceremos la importancia del SI,
sus magnitudes, las unidades, los múltiplos y submúltiplos. La actividad en el aula permitirá reforzar
conocimientos y la utilización y aplicación práctica.
Exitos en elaprendizaje,
&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&&
Siguiente tema para desarrollo en el aula.
Siguiente tema para desarrollo en el aula.
NOTACIÓN CIENTIFICA Y CIFRAS SIGNIFICATIVAS
Convertir números decimales a notación científica y viceversa
0.000 000 450 123 = 4,5 X 10-7
189 350 000
000 000 = 1,89 35 x 10
14
La notación científica se utiliza para
expresar números muy grandes o muy pequeños. Un número en notación científica
se escribe como el producto de un número (entero o decimal) y una potencia de
10. El número tiene un dígito a la izquierda del punto decimal. La potencia de
diez indica cuantos lugares se ha corrido el punto decimal.
El número decimal 0.00000065 escrito en
notación científica sería 6.5 x 10-7 porque el punto decimal se movió 7 lugares
hacia la derecha para formar el número 6.5. Es equivalente a
6.5*0.1*0.1*0.1*0.1*0.1*0.1*0.1
Un número decimal menor a 1 se puede
convertir a notación científica disminuyendo la potencia de diez en uno por
cada lugar en que el punto decimal se corrió hacia la derecha.
Los números en notación científica se
pueden escribir en diferentes formas. El número 6.5 x 10-7 se podría
también escribir como 6.5e-7.
SIGA LOS PASOS Y TENDRÁ
MUCHO ÉXITO.
http://ciencialgmc.blogspot.com/2014/09/serie-como-calcular-fisica-y-quimica-3.html
Ejercicios de conversión de medidas
1. ¿Cuántos litros existiran en 16 500 mL?
2. ¿Cuantos metros existen en una distancia de 37689 Km?
Para calcular el peso de los cuerpos es necesario recordar:
DIFERENC IA ENTRE MASA Y PESO
.
.
3. Si una estatuilla de Au, tienen una masa de 1000,75 g ¿Cuál será su masa en Kg ?
.......................................................................
.....................................................................
4. Si la estatuilla tiene una masa de 1000,75 g
en la tierra y se la lleva a la luna, ¿Cuál será su
peso en la Luna?, sabiendo que la gravedad de la tierra
es seis veces mayor a la de la luna. Gravedad en la luna es
1,63 m/s 2
Datos
m = 1000,75 g = .............
Kg
g = 1.63 m/s2 en la luna
Peso, se calcula en Newton;
N= m x g
(la masa debe expresarse en Kg, y la gravedad en m/s2 )
Aplica la ecuación y descubrías que el peso es mayor en la
luna.
DISTANCIAS TERRESTRES DE ECUADOR, ÚTIL PARA EJERCICIOS DE CONVERSIÓN DE UNIDADES.
http://www.edina.com.ec/guia-telefonica/distancias-terrestres-ecuador.aspx
A PREPARESE PARA EXAMEN
1) La densidad del Aluminio es 2,70 g/cm3 . ¿Qué volumen ocupará una
masa de 5 Kg? exprese la respuesta en notación cientifica y con 3 CS
DATOS
d=
V=
m=
d=m/v
Ecuación para calcular el volumen: V= m/d
Estrategia:
1) como la masa se expresa en Kg, debe convertir a: g
2) aplica la ecuación y obtendrá el volumen en cm3
d=
V=
m=
d=m/v
Ecuación para calcular el volumen: V= m/d
Estrategia:
1) como la masa se expresa en Kg, debe convertir a: g
2) aplica la ecuación y obtendrá el volumen en cm3



 .
.